Série de documents analytiques et techniques sur les comptes et la statistique de l'environnement
Évaluation de l’écosystème des marais salés : élaboration de comptes écosystémiques
Passer au texte
Début de l'encadré
Début du texte de la boîte
Remerciements
Nous tenons à exprimer notre gratitude à nos collègues Jennie Wang, Katie Strong, Kirk Donaldson et Paula Maloney, pour leurs précieuses contributions tout au long de la préparation de cet article.
Nous souhaitons aussi remercier nos pairs évaluateurs :
Andrew Cooper, Pêches et Océans Canada
Koreen Millard, Carleton University
Alan Hanson, Environnement et Changement climatique Canada
Kirsten Ellis, CB Wetlands & Environmental Specialists
Gia Paola, James Paterson et Nic McLellan, Canards Illimités Canada
Leur aide et leurs commentaires utiles ont été essentiels à la réalisation de cet article.
Fin du texte de la boîte
1. Introduction
Les préoccupations croissantes au sujet des risques économiques, sociaux et sanitaires qui pèsent sur les collectivités canadiennes en raison des changements climatiques et de la perte de biodiversité ont mené à la création du Recensement de l’environnement (Statistique Canada, 2022). Ce nouveau programme vise à rendre compte des écosystèmes au Canada, et fournit aux Canadiens des renseignements leur permettant de prendre des décisions fondées sur des données probantes dans le but de protéger, de restaurer, d’enrichir et de pérenniser notre environnement.
En s’appuyant sur le cadre du Système de comptabilité économique et environnementale — Comptes des écosystèmes (SCEE-CE) des Nations Unies (Nations Unies et coll., 2021), le Recensement de l’environnement permettra d’élaborer des comptes écosystémiques exhaustifs qui faciliteront le suivi, au fil du temps, des changements dans l’étendue et la condition des écosystèmes, ainsi que dans les services écosystémiques qu’ils fournissent (figure 1). Ces comptes contribueront à combler l’écart entre les données économiques et environnementales au profit des décideurs. En effet, en comblant cette lacune et en mettant l’accent sur la valeur des milieux naturels et leurs bienfaits pour la société, ces comptes appuieront l’analyse des avantages et des inconvénients entre l’économie et l’environnement.
Au fil du temps, le Recensement de l’environnement mènera à l’élaboration de comptes écosystémiques pour de nombreux types d’écosystèmes au Canada. Les marais salés ― un type d’écosystème côtier ― constitueront l’un des premiers domaines d’intérêt du Recensement de l’environnement. Même si le Canada a le plus long littoral du monde, il existe des lacunes en matière de données sur ses écosystèmes côtiers, car la collecte de données porte habituellement sur des écosystèmes traditionnellement reconnus comme ayant une valeur économique. Toutefois, on reconnaît de plus en plus l’importance des écosystèmes côtiers, tels que les marais salés, en ce qui concerne l’adaptation aux changements climatiques et l’atténuation de ceux-ci.
Les marais salés fournissent des services écosystémiques précieux, entre autres : la séquestration du carbone, la protection contre les tempêtes et les inondations côtières, le maintien de la quantité et de la qualité de l’eau, la fourniture d’habitats et le soutien aux activités récréatives. Pour aller de l’avant, il importe de recueillir des données sur ces écosystèmes, car ils sont vulnérables aux répercussions des changements climatiques (Lemmen et coll., 2016) et risquent de disparaître, de même que les services qu’ils fournissent.
La présente publication marque le début de la recherche et de la création de partenariats en continu qui éclaireront l’élaboration de comptes pilotes sur les marais salés. Le présent document propose un cadre de comptabilité des écosystèmes de marais salés au Canada. Ce cadre a expressément été élaboré avec suffisamment de souplesse pour permettre à d’autres groupes de l’utiliser et de l’adapter à leurs besoins particuliers. Au cours de la prochaine année, il sera utilisé pour commencer à produire des comptes, ce qui générera un nombre croissant de tableaux et d’autres produits de données. Les sources de données ainsi que la méthodologie de collecte et d’analyse des données seront peaufinées au fil des ans, à mesure que les comptes seront mis au point en collaboration avec divers ordres de gouvernement, industries, groupes autochtones et organisations non gouvernementales. Tout au long du processus, les tableaux de comptes seront continuellement enrichis et mis à jour à l’aide de données provenant de multiples sources et de modèles simples, et grâce à la participation d’experts.
Idéalement, les comptes et les renseignements supplémentaires connexes seraient produits chaque année; toutefois, davantage de recherches et de données sont nécessaires à la réalisation de cet objectif. Les premiers comptes pilotes seront compilés de façon opportune et refléteront les lacunes en matière de connaissances et de données décrites dans le présent document. Certaines variables seront donc manquantes, incomplètes, estimées approximativement ou présentées au moyen de données de substitution.
La première section de ce document présente brièvement l’étendue des marais salés. Les sections suivantes portent sur et les comptes de la condition des écosystèmes et des services écosystémiques, y compris les variables proposées, la méthodologie, les mesures ainsi que sur les sources de données, tout en décrivant les difficultés et les limites. Le présent document technique fournit également une base pour l’élaboration des comptes de marais salés et orientera l’amélioration des comptes des écosystèmes côtiers et océaniques dans le cadre du Recensement de l’environnement, ce qui permettra finalement de brosser un tableau complet de l’état des écosystèmes et de leurs apports aux Canadiens.
Figure 1
Description de la figure 1
La figure a pour titre « Aperçu des composantes du cadre du Système de comptabilité économique et environnementale – Comptes des écosystèmes (SCEE – CE) ». Elle comporte une image sous laquelle sont présentés trois encadrés numérotés qui en expliquent les principaux éléments.
L’image montre un marais salé et ses principales composantes. On y retrouve une petite collectivité voisine comptant trois maisons reliées par une route. Le long de la rive et dans le marais, il y a une épaisse végétation, avec de nombreuses variétés d’herbes et des oiseaux. Une fine ligne grise traverse le quart inférieur de l’image. Sous cette ligne, il y a une zone transparente d’un bleu plus foncé où l’on voit des plantes, des poissons et des crabes sous l’eau.
En dessous de l’image se trouvent trois encadrés numérotés qui contiennent le texte suivant :
- Étendue : Le compte de L’étendue effectue un suivi des changements observés dans la zone couverte par différents écosystèmes. Par exemple, les limites de chaque marais salé sont mesurées de manière répétée pour comprendre les changements liés à l’étendue.
- Condition : Le compte de la condition compile des renseignements sur la santé des écosystèmes. En ce qui concerne les marais salés, cela implique le suivi de caractéristiques comme la durée des inondations dues à la marée qui surviennent à chaque marais particulier.
- Services écosystémiques : Les renseignements issus des comptes de l’étendue et de la condition aident à mesurer les services écosystémiques. Les marais salés, par exemple, fournissent un important service de protection côtière. Des marais salés en santé qui ne rétrécissent pas peuvent contribuer à protéger les maisons et les infrastructures des inondations côtières.
Début du texte de la boîte
Encadré : Que sont les marais salés?
La typologie globale des écosystèmes de l’Union internationale pour la conservation de la nature (UICN) est la classification de référence du Système de comptabilité économique et environnementale — Comptes des écosystèmes pour la délimitation des écosystèmes. Selon cette typologie, les deltas des fleuves côtiers, les forêts intertidales et les marais salés côtiers sont classés comme des groupes fonctionnels écosystémiques distincts dans le biome des marais saumâtres (Keith et coll., 2020).
Les marais salés sont un type de milieux humides côtiers se trouvant dans les latitudes moyennes à élevées à l’échelle mondiale, habituellement le long des côtes abritées et dans les estuaires (McOwen et coll., 2017). Plus particulièrement, on les retrouve dans la zone intertidale supérieure entre le niveau moyen de la mer et la marée haute, là où une végétation tolérante au sel et aux inondations peut pousser. Selon l’emplacement des marais salés par rapport à l’océan, les niveaux globaux de salinité peuvent varier. Aux fins des comptes pilotes sur les marais salés de Statistique Canada, tout marais soumis à l’action des marées et qui n’est pas uniquement soumis à l’eau douce est considéré comme un marais salé.
Les marais salés ont une topographie relativement plate et comportent des réseaux de chenaux exposés aux inondations par la marée. À marée haute ou très haute, la surface entière du marais peut être inondée. Les marais salés peuvent également comporter des dépressions à la surface appelées « marelles », où l’eau s’accumule (French, 2019). Les inondations intermittentes par la marée et la salinité sont des caractéristiques de ces écosystèmes et produisent des gradients hydrologiques et de salinité à petite échelle sur la surface du marais (Keith et coll., 2020). Ces gradients ont une incidence sur l’organisation des communautés végétales et le fonctionnement global de l’écosystème (Pennings et Bertness, 2001).
Malgré le stress lié aux inondations et à la salinité, les marais salés abritent des plantes graminiformes (graminoïdes), des herbes et des petits arbustes qui sont très productifs et résistants au stress (McOwen et coll., 2017). La végétation des marais salés joue un rôle important dans la stabilisation des sols des marais et favorise leur formation et leur croissance (French, 2019; Mudd et coll., 2010; Van Eerdt, 1985). Étant donné que les marais salés sont des systèmes sédimentaires, lorsqu’ils disposent d’une quantité suffisante de sédiments, ils peuvent croître à la verticale pour s’adapter aux variations du niveau de la mer et des conditions côtières, ce qui en fait d’excellents moyens de défense contre les changements climatiques en zone côtière (Grenfell et coll., 2019; Schile et coll., 2014).
Les marais salés fournissent d’importants services écosystémiques, entre autres : la séquestration du carbone, la protection contre les tempêtes et les inondations côtières, le maintien de la qualité et de la quantité de l’eau, la fourniture d’habitats et le soutien aux activités récréatives. Ces services jouent un rôle évident au chapitre du bien-être des Canadiens, de l’économie canadienne et des efforts déployés pour atteindre les cibles du Groupe d’experts intergouvernemental sur l’évolution du climat. Les marais salés constituent également un lien important entre les environnements terrestres et marins (Jänes et coll., 2020), et soutiennent des secteurs d’activité comme la pêche commerciale. Par conséquent, ils ont été ciblés parmi les premiers écosystèmes à faire l’objet de comptes écosystémiques dans le cadre du nouveau Recensement de l’environnement (Statistique Canada, 2022).
Fin du texte de la boîte
2. Application du Système de comptabilité économique et environnementale — Comptes des écosystèmes aux marais salés du Canada
2.1 Étendue
Comme les marais salés n’ont pas été entièrement cartographiés au Canada, les estimations de leur étendue (tableau 1) ont été compilées à partir des meilleures données disponibles (pour obtenir des renseignements sur la méthodologie, voir l’annexe A). Les ensembles de données proviennent de sources internationales, provinciales et fédérales pour la période allant de 1995 à aujourd’hui. Les données ont été acquises principalement par télédétection et imagerie satellitaire et certaines données ont été validées au sol par les organismes ayant procédé à la collecte. Ensemble, ces données couvrent la majeure partie du pays (cartes 1 et cartes 2). Il convient de noter qu’il y a une insuffisance de données sur l’étendue des marais salés dans le Nord et à Terre-Neuve-et-Labrador où, au mieux, certaines occurrences sont confirmées (lesquelles sont désignées par des points ou des lignes sur les cartes 1 et cartes 2) sans que des zones ne soient explicitement cartographiées. La plupart des régions dont l’étendue des marais salés n’est pas explicitement cartographiée sont le reflet d’un manque de données sur l’étendue plutôt que d’une absence de marais salés. Lorsque de meilleures données satellitaires et de meilleures méthodes de classification de la couverture terrestre deviendront disponibles, la précision des données s’améliorera et les lacunes en matière de données seront comblées au fil du temps. À l’heure actuelle, l’étendue estimée comprend 3 602 km2 de superficie de marais salés à l’échelle du pays, auxquels s’ajoutent 1 304 km de littoral, classés comme des marais salés sans zone connexe.
La couverture temporelle de ces données présente plusieurs problèmes. Premièrement, les données fournissent un piètre repère historique de l’étendue des marais salés. Il y a un long historique de conversion des marais en terres agricoles au Canada. Les marais convertis ont été utilisés comme terres agricoles par les premiers colonisateurs, en particulier par les Acadiens (à partir du 17e siècle) (Milligan, 1987). Ce problème se remarque particulièrement dans les régions du pays pour lesquelles on ne dispose que d’ensembles de données modernes. Deuxièmement, l’utilisation d’une étendue fixe ne permet pas de suivre les variations de l’étendue qui découlent des processus naturels de migration et d’érosion (voir la section 2.2.2.1), l’évolution des marais sous l’effet des changements climatiques, la transformation et la perte de marais attribuables à la construction, ni les gains en étendue amenés par les projets de restauration, qui sont de plus en plus fréquents. Ces enjeux compliquent l’établissement des comptes d’étendue, et soulignent la nécessité de délimiter l’écosystème des marais salés régulièrement afin de rendre compte des variations de son étendue, ce que pourrait permettre la télédétection (Lopes et coll., 2020; National Oceanic and Atmospheric Administration : Office for Coastal Management, s. d.). Par conséquent, des mises à jour régulières seront apportées aux comptes de l’étendue des marais salés, à mesure que de nouvelles données seront disponibles.
Carte 1
Description de la carte 1
Cette carte, intitulée « Étendue des marais salés canadiens, 2022 », fournit une représentation visuelle de l’étendue de l’écosystème des marais salés au Canada et porte sur la période allant de 1995 à 2021. Les données ont été produites selon les méthodes décrites à l’annexe A.
Une grande carte du Canada figure sur la page, accompagnée d’une légende, en haut à droite. Sur la carte, les biorégions marines sont tracées en bleu et étiquetées au moyen d’un code numérique. Les lignes noires pointillées indiquent les frontières provinciales et territoriales. Dans la légende, les codes des biorégions marines et leurs noms respectifs sont fournis à titre de référence. La carte indique l’emplacement des marais salés au Canada, lesquels sont symbolisés par des polygones roses ainsi que par des points et des lignes jaunes. Les données des zones délimitées par des polygones, des lignes et des points sont mutuellement exclusives sur le plan géographique.
La carte montre qu’il y a des marais salés sur toutes les côtes du Canada. L’étendue des marais salés est plus grande sur les côtes de la Colombie-Britannique, du Nouveau-Brunswick, de l’Île-du-Prince-Édouard et de la moitié inférieure de la baie d’Hudson. Le long du golfe du Saint-Laurent, de Terre-Neuve-et-Labrador, de la partie supérieure de la baie d’Hudson et du détroit d’Hudson ainsi que dans l’Arctique, leur étendue est fragmentée. Par ailleurs, il y a une certaine étendue dans l’archipel Arctique. Dans les Territoires du Nord-Ouest, les marais salés sont particulièrement concentrés dans le delta du fleuve Mackenzie. Certaines zones qui n’affichent pas d’étendue de marais salés pourraient être le résultat d’un manque de données plutôt que d’une absence de marais salés.
Note : Les données portent sur la période allant de 1995 à 2021.
Sources : Ministère de l’Environnement et des Gouvernements locaux du Nouveau-Brunswick, 2021, Terres humides, http://www.snb.ca/geonb1/f/DC/catalogue-F.asp (site consulté le 28 janvier 2022); Pêches et Océans Canada, 2016, Biorégions marines fédérales, https://ouvert.canada.ca/data/fr/dataset/23eb8b56-dac8-4efc-be7c-b8fa11ba62e9 (site consulté le 26 janvier 2022); Pêches et Océans Canada, 2018, Inventaire des marais dans la baie des Chaleurs, l’estuaire et le golfe du Saint-Laurent, https://ouvert.canada.ca/data/fr/dataset/49d8622c-e42b-4d8a-840d-c50b10e710c6 (site consulté le 28 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification des Rivages de l’Arctique Canadien, https://ouvert.canada.ca/data/fr/dataset/1c61d457-4d03-4f3a-9005-9aabb5a201bb (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification du rivage du Nord de la Colombie-Britannique, https://ouvert.canada.ca/data/fr/dataset/09051eee-c28a-4746-8033-8e85815f4c73 (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification du rivage de l’Atlantique, https://ouvert.canada.ca/data/fr/dataset/30449352-2556-42df-9ffe-47ea8e696f91 (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification des Rivages de l’Ontario, https://ouvert.canada.ca/data/fr/dataset/27515ccc-0cad-4f7d-b8ab-2a909090f128 (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification des Rivages du Québec – Fleuve Saint-Laurent, https://ouvert.canada.ca/data/fr/dataset/ba580518-59e8-4d1c-b3ef-41d2658e6965 (site consulté le 25 janvier 2022); GeoBC, 2011, Shorezone observed habitat polygons, https://catalogue.data.gov.bc.ca/dataset/shorezone-observed-habitat-polygons (site consulté le 25 janvier 2022); Information sur les terres de l’Ontario, 2009, Far North land cover (v1.4), https://geohub.lio.gov.on.ca/documents/lio::far-north-land-cover/about (site consulté le 28 janvier 2022); McOwen C.J., et coll., 2017, « A global map of saltmarshes (v6.1) », Biodiversity Data Journal, vol. 5, no e11764, https://doi.org/10.3897/BDJ.5.e11764 et https://doi.org/10.34892/07vk-ws51 (sites consultés le 28 janvier 2022); Ministère des Forêts, de la Faune et des Parcs du Québec, 2017, Végétation du Nord québécois, https://www.donneesquebec.ca/recherche/dataset/vegetation-du-nord-quebecois (site consulté le 25 janvier 2022); Ministère des Ressources naturelles de la Nouvelle-Écosse, 2018, Classification écologique des terres 2015, https://nsgi.novascotia.ca/gdd/ (site consulté le 28 janvier 2022).
| Forme | Limites |
|---|---|
| Ligne pointillée | Provinces et territoires |
| Contour bleu | Biorégion marine |
| Couleur | Marais salés |
| Point jaune | Emplacement d’un marais salé |
| Ligne jaune | Emplacement d’un marais salé |
| Polygone rose | Zone de marais salés |
| Étiquette | Biorégion marine |
|---|---|
| 1 | Détroit de Georgia |
| 2 | Plate-forme Sud |
| 3 | Zone extracôtière du Pacifique |
| 4 | Plate-forme Nord |
| 5 | Bassin arctique |
| 6 | Arctique de l’Ouest |
| 7 | Archipel Arctique |
| 8 | Arctique de l’Est |
| 9 | Complexe de la baie d’Hudson |
| 10 | Plates-formes de Terre-Neuve-et-Labrador |
| 11 | Plate-forme Néo-Écossaise |
| 12 | Estuaire et golfe du Saint-Laurent |
| Biorégion marine | Superficie | Longueur | Point |
|---|---|---|---|
| km2 | km | nombre | |
| Détroit de Georgia | 95 | Note ..: indisponible pour une période de référence précise | Note ..: indisponible pour une période de référence précise |
| Plate-forme Sud | 78 | Note ..: indisponible pour une période de référence précise | Note ..: indisponible pour une période de référence précise |
| Plate-forme Nord | 635 | 7 | Note ..: indisponible pour une période de référence précise |
| Arctique de l'Ouest | Note ..: indisponible pour une période de référence précise | 382 | 5 |
| Arctique de l'Est | Note ..: indisponible pour une période de référence précise | 2 | 1 |
| Complexe de la baie d'Hudson | 2 271 | 429 | 1 |
| Plate-formes de Terre-Neuve-et-Labrador | Note ..: indisponible pour une période de référence précise | 171 | Note ..: indisponible pour une période de référence précise |
| Plate-forme Néo-Écossaise | 214 | 99 | Note ..: indisponible pour une période de référence précise |
| Estuaire et golfe du Saint-Laurent | 309 | 214 | 3 |
| Total | 3 602 | 1 304 | 10 |
| .. indisponible pour une période de référence précise | |||
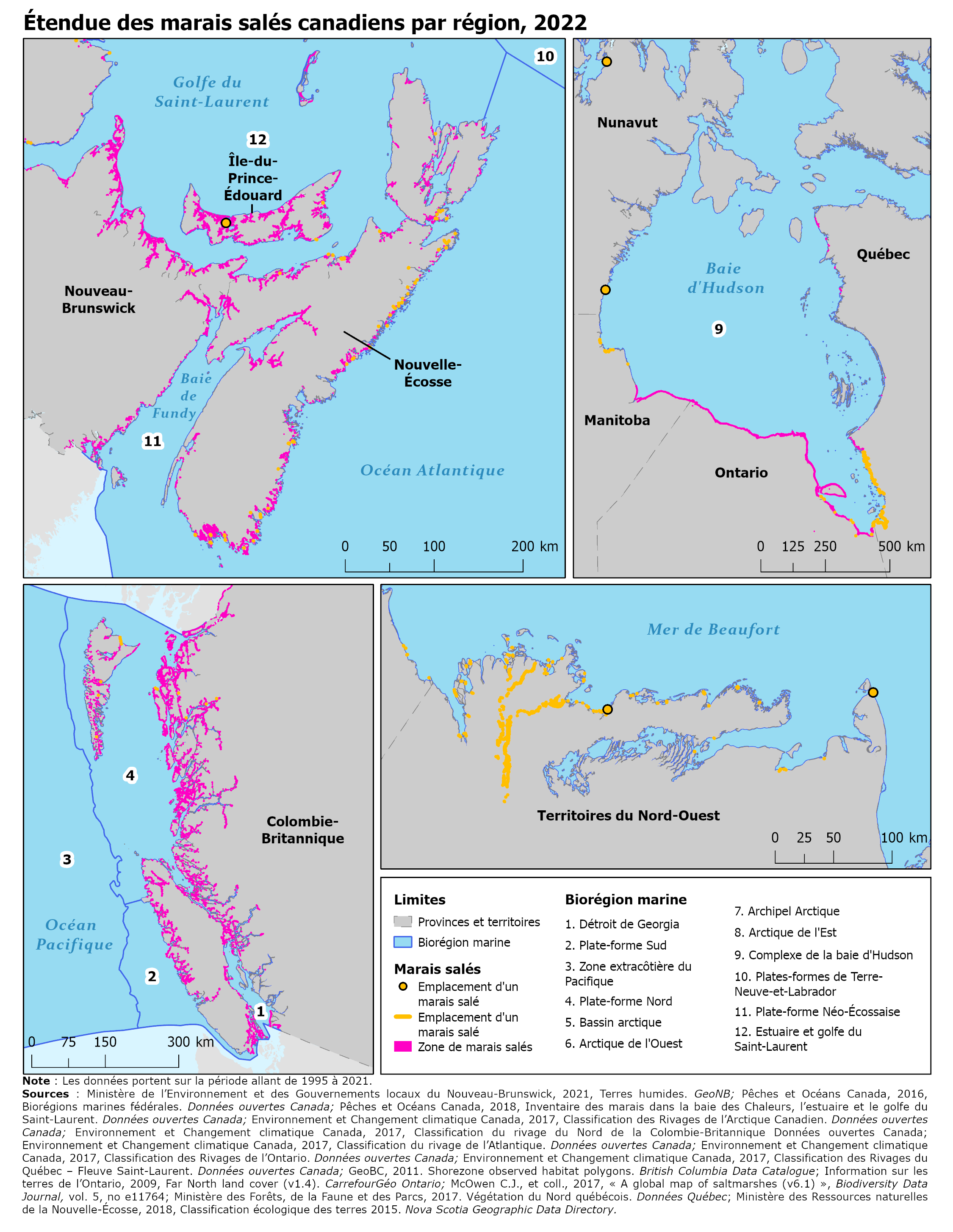
Description de la carte 2
Cette carte, intitulée « Étendue des marais salés canadiens par région, 2022 », fournit une représentation visuelle de l’étendue de l’écosystème des marais salés au Canada et porte sur la période allant de 1995 à 2021. Les données ont été produites selon les méthodes décrites à l’annexe A.
Quatre cartes figurent sur la page, accompagnées d’une légende, en bas à droite. La première (en haut à gauche) est une carte de la côte Est (région des Maritimes), la deuxième (en haut à droite) est une carte de la baie d’Hudson, la troisième (en bas à gauche) est une carte de la côte Ouest (Colombie-Britannique), et la quatrième est une carte de la région nord-est de la côte des Territoires du Nord-Ouest.
Sur toutes les cartes, les biorégions marines sont tracées en bleu et étiquetées au moyen d’un code numérique. Les lignes noires pointillées indiquent les frontières provinciales et territoriales. Dans la légende, les codes des biorégions marines et leurs noms respectifs sont fournis à titre de référence. Les cartes indiquent l’emplacement des marais salés au Canada, lesquels sont symbolisés par des polygones roses ainsi que par des points et des lignes jaunes. Les données des zones délimitées par des polygones, des lignes et des points sont mutuellement exclusives sur le plan géographique.
Les cartes montrent que la région des Maritimes et la côte Ouest sont presque entièrement bordées par des marais salés. Dans la baie d’Hudson, il y a une importante bande côtière de marais salés s’étendant du centre du Manitoba vers le sud jusqu’à la pointe nord-est de la baie James. Dans les Territoires du Nord-Ouest, il y a une importante bande côtière de marais salés le long du delta du fleuve Mackenzie. Certaines zones qui n’affichent pas d’étendue de marais salés pourraient être le résultat d’un manque de données plutôt que d’une absence de marais salés.
Note : Les données portent sur la période allant de 1995 à 2021.
Sources : Ministère de l’Environnement et des Gouvernements locaux du Nouveau-Brunswick, 2021, Terres humides, http://www.snb.ca/geonb1/f/DC/catalogue-F.asp (site consulté le 28 janvier 2022); Pêches et Océans Canada, 2016, Biorégions marines fédérales, https://ouvert.canada.ca/data/fr/dataset/23eb8b56-dac8-4efc-be7c-b8fa11ba62e9 (site consulté le 26 janvier 2022); Pêches et Océans Canada, 2018, Inventaire des marais dans la baie des Chaleurs, l’estuaire et le golfe du Saint-Laurent, https://ouvert.canada.ca/data/fr/dataset/49d8622c-e42b-4d8a-840d-c50b10e710c6 (site consulté le 28 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification des Rivages de l’Arctique Canadien, https://ouvert.canada.ca/data/fr/dataset/1c61d457-4d03-4f3a-9005-9aabb5a201bb (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification du rivage du Nord de la Colombie-Britannique, https://ouvert.canada.ca/data/fr/dataset/09051eee-c28a-4746-8033-8e85815f4c73 (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification du rivage de l’Atlantique, https://ouvert.canada.ca/data/fr/dataset/30449352-2556-42df-9ffe-47ea8e696f91 (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification des Rivages de l’Ontario, https://ouvert.canada.ca/data/fr/dataset/27515ccc-0cad-4f7d-b8ab-2a909090f128 (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification des Rivages du Québec – Fleuve Saint-Laurent, https://ouvert.canada.ca/data/fr/dataset/ba580518-59e8-4d1c-b3ef-41d2658e6965 (site consulté le 25 janvier 2022); GeoBC, 2011, Shorezone observed habitat polygons, https://catalogue.data.gov.bc.ca/dataset/shorezone-observed-habitat-polygons (site consulté le 25 janvier 2022); Information sur les terres de l’Ontario, 2009, Far North land cover (v1.4), https://geohub.lio.gov.on.ca/documents/lio::far-north-land-cover/about (site consulté le 28 janvier 2022); McOwen C.J., et coll., 2017, « A global map of saltmarshes (v6.1) », Biodiversity Data Journal, vol. 5, no e11764, https://doi.org/10.3897/BDJ.5.e11764 et https://doi.org/10.34892/07vk-ws51 (sites consultés le 28 janvier 2022); Ministère des Forêts, de la Faune et des Parcs du Québec, 2017, Végétation du Nord québécois, https://www.donneesquebec.ca/recherche/dataset/vegetation-du-nord-quebecois (site consulté le 25 janvier 2022); Ministère des Ressources naturelles de la Nouvelle-Écosse, 2018, Classification écologique des terres 2015, https://nsgi.novascotia.ca/gdd/ (site consulté le 28 janvier 2022).
| Forme | Limites |
|---|---|
| Ligne pointillée | Provinces et territoires |
| Contour bleu | Biorégion marine |
| Couleur | Marais salés |
| Point jaune | Emplacement d’un marais salé |
| Ligne jaune | Emplacement d’un marais salé |
| Polygone rose | Zone de marais salés |
| Étiquette | Biorégion marine |
|---|---|
| 1 | Détroit de Georgia |
| 2 | Plate-forme Sud |
| 3 | Zone extracôtière du Pacifique |
| 4 | Plate-forme Nord |
| 5 | Bassin arctique |
| 6 | Arctique de l’Ouest |
| 7 | Archipel Arctique |
| 8 | Arctique de l’Est |
| 9 | Complexe de la baie d’Hudson |
| 10 | Plates-formes de Terre-Neuve-et-Labrador |
| 11 | Plate-forme Néo-Écossaise |
| 12 | Estuaire et golfe du Saint-Laurent |
| Biorégion marine | Superficie | Longueur | Point |
|---|---|---|---|
| km2 | km | nombre | |
| Détroit de Georgia | 95 | Note ..: indisponible pour une période de référence précise | Note ..: indisponible pour une période de référence précise |
| Plate-forme Sud | 78 | Note ..: indisponible pour une période de référence précise | Note ..: indisponible pour une période de référence précise |
| Plate-forme Nord | 635 | 7 | Note ..: indisponible pour une période de référence précise |
| Arctique de l'Ouest | Note ..: indisponible pour une période de référence précise | 382 | 5 |
| Arctique de l'Est | Note ..: indisponible pour une période de référence précise | 2 | 1 |
| Complexe de la baie d'Hudson | 2 271 | 429 | 1 |
| Plate-formes de Terre-Neuve-et-Labrador | Note ..: indisponible pour une période de référence précise | 171 | Note ..: indisponible pour une période de référence précise |
| Plate-forme Néo-Écossaise | 214 | 99 | Note ..: indisponible pour une période de référence précise |
| Estuaire et golfe du Saint-Laurent | 309 | 214 | 3 |
| Total | 3 602 | 1 304 | 10 |
| .. indisponible pour une période de référence précise | |||
| Biorégion marine | Superficie | Longueur | Point |
|---|---|---|---|
| km2 | km | nombre | |
| Détroit de Georgia | 95 | Note ..: indisponible pour une période de référence précise | Note ..: indisponible pour une période de référence précise |
| Plate-forme Sud | 78 | Note ..: indisponible pour une période de référence précise | Note ..: indisponible pour une période de référence précise |
| Plate-forme Nord | 635 | 7 | Note ..: indisponible pour une période de référence précise |
| Arctique de l'Ouest | Note ..: indisponible pour une période de référence précise | 382 | 5 |
| Arctique de l'Est | Note ..: indisponible pour une période de référence précise | 2 | 1 |
| Complexe de la baie d'Hudson | 2 271 | 429 | 1 |
| Plate-formes de Terre-Neuve-et-Labrador | Note ..: indisponible pour une période de référence précise | 171 | Note ..: indisponible pour une période de référence précise |
| Plate-forme Néo-Écossaise | 214 | 99 | Note ..: indisponible pour une période de référence précise |
| Estuaire et golfe du Saint-Laurent | 309 | 214 | 3 |
| Total | 3 602 | 1 304 | 10 |
|
.. indisponible pour une période de référence précise Note: Les données portent sur la période allant de 1995 à 2021. La surface polygonale, les lignes et les étendues ponctuelles sont des zones distinctes de marais salés. Sources: Ministère de l’Environnement et des Gouvernements locaux du Nouveau-Brunswick, 2021, Terres humides, http://www.snb.ca/geonb1/f/DC/catalogue-F.asp (site consulté le 28 janvier 2022); Pêches et Océans Canada, 2016, Biorégions marines fédérales, https://ouvert.canada.ca/data/fr/dataset/23eb8b56-dac8-4efc-be7c-b8fa11ba62e9 (site consulté le 26 janvier 2022); Pêches et Océans Canada, 2018, Inventaire des marais dans la baie des Chaleurs, l’estuaire et le golfe du Saint-Laurent, https://ouvert.canada.ca/data/fr/dataset/49d8622c-e42b-4d8a-840d-c50b10e710c6 (site consulté le 28 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification des Rivages de l’Arctique Canadien, https://ouvert.canada.ca/data/fr/dataset/1c61d457-4d03-4f3a-9005-9aabb5a201bb (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification du rivage du Nord de la Colombie-Britannique, https://ouvert.canada.ca/data/fr/dataset/09051eee-c28a-4746-8033-8e85815f4c73 (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification du rivage de l’Atlantique, https://ouvert.canada.ca/data/fr/dataset/30449352-2556-42df-9ffe-47ea8e696f91 (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification des Rivages de l’Ontario, https://ouvert.canada.ca/data/fr/dataset/27515ccc-0cad-4f7d-b8ab-2a909090f128 (site consulté le 25 janvier 2022); Environnement et Changement climatique Canada, 2017, Classification des Rivages du Québec – Fleuve Saint-Laurent, https://ouvert.canada.ca/data/fr/dataset/ba580518-59e8-4d1c-b3ef-41d2658e6965 (site consulté le 25 janvier 2022); GeoBC, 2011, Shorezone observed habitat polygons, https://catalogue.data.gov.bc.ca/dataset/shorezone-observed-habitat-polygons (site consulté le 25 janvier 2022); Information sur les terres de l’Ontario, 2009, Far North land cover (v1.4), https://geohub.lio.gov.on.ca/documents/lio::far-north-land-cover/about (site consulté le 28 janvier 2022); McOwen C.J., et coll., 2017, « A global map of saltmarshes (v6.1) », Biodiversity Data Journal, vol. 5, no e11764, https://doi.org/10.3897/BDJ.5.e11764 et https://doi.org/10.34892/07vk-ws51 (sites consultés le 28 janvier 2022); Ministère des Forêts, de la Faune et des Parcs du Québec, 2017, Végétation du Nord québécois, https://www.donneesquebec.ca/recherche/dataset/vegetation-du-nord-quebecois (site consulté le 25 janvier 2022); Ministère des Ressources naturelles de la Nouvelle-Écosse, 2018, Classification écologique des terres 2015, https://nsgi.novascotia.ca/gdd/ (site consulté le 28 janvier 2022). |
|||
2.2 Condition
À l’aide du cadre du SCEE-CE, un ensemble de variables comptables a été élaboré pour décrire le « comportement typique » à long terme des marais salés et pour rendre compte des changements au fil du temps (Nations Unies et coll., 2021). Selon la typologie de la condition des écosystèmes du SCEE-CE (Nations Unies et coll., 2021), au moins une variable dans chaque catégorie est proposée pour décrire de façon détaillée la condition des marais salés (tableau 2). Ces variables ont été sélectionnées en fonction des critères décrits à l’annexe 5.1 du SCEE-CE, ce qui garantit qu’elles sont appropriées sur le plan conceptuel, raisonnablement utilisables, détaillées et parcimonieuses.
Les variables choisies sont décrites dans cette section de façon plus ou moins détaillée. On y traite de la pertinence écologique des variables, des possibilités au chapitre des sources de données et des méthodes, des limites et des lacunes en matière de données, ainsi que des options proposées au chapitre des mesures. Les mesures peuvent également comprendre des suggestions de données de substitution dans les cas où il est difficile ou impossible d’obtenir des mesures directes. Dans la mesure du possible, lors de l’application du cadre, les changements seront mesurés pour chaque marais. Au fil de l’élaboration des comptes, les variables et les mesures présentées pourront être regroupées pour former des indices de la condition de l’écosystème.
Au moment de la production des comptes, des tableaux supplémentaires seront également présentés, ce qui facilitera l’interprétation des changements à la condition de l’écosystème. Les tableaux supplémentaires comprendront des données sur les facteurs ayant des répercussions positives et négatives sur les marais salés. Ils fourniront également des données sur les variables climatiques pertinentes (p. ex. la température de l’air, la température de la surface de la mer, la salinité à la surface de la mer, les précipitations et les jours sous le point de congélation) ainsi que sur les modifications positives apportées par l’humain (p. ex. la gestion des espèces envahissantes, la restauration et la création intentionnelles de marais salés, les pratiques de gouvernance autochtones et la protection législative).
| Catégorie | Variable |
|---|---|
| A : Caractéristiques abiotiques de l’écosystème | |
| A1 : Condition physique | Variation de l’élévation de la surface du marais (accrétion, érosion, chenaux d’eau, dépressions) |
| Hydrologie des marées | |
| A2 : Condition chimique | Salinité |
| Pollution | |
| B : Caractéristiques biotiques de l’écosystème | |
| B1 : Condition de la composition | Communauté végétale (espèces dominantes et envahissantes, zonation) |
| Biodiversité animale (espèces indigènes et envahissantes) | |
| B2 : Condition structurelle | Structure de la végétation (densité des tiges, biomasse) |
| B3 : Condition fonctionnelle | Perturbations (varech, glace, herbivorisme) |
| C : Caractéristiques du paysage | |
| C1 : Paysages terrestres et marins | Barrières et restrictions intertidales |
| Utilisation des terres avoisinantes | |
| Configuration du paysage |
2.2.1 Condition physique
Les variables de la condition physique fournissent une description physique des composantes abiotiques (non vivantes) d’un écosystème (Nations Unies et coll., 2021). Pour les marais salés, cela comprend les variations de l’élévation de la surface du marais et les caractéristiques des inondations par la marée.
2.2.1.1 Variation de l’élévation de la surface du marais (accrétion, érosion, chenaux d’eau et dépressions)
Le fait que l’élévation de la surface du marais augmente ou diminue par rapport au niveau moyen de la mer est déterminé par plusieurs processus en interaction (French, 2019). Au-dessus du sol, des matières organiques et inorganiques (p. ex. des sédiments et des matières végétales) se déposent sur le marais (appelé processus d’accrétion) ou s’érodent de sa surface (Neubauer, 2008). Sous la surface du sol, les processus de décomposition et de compactage se produisent, et les racines et rhizomes enrichissent le sol de matière organique. Ces processus souterrains et en surface peuvent également être influencés par les variations du niveau de la mer et les changements climatiques (Chmura et Hung, 2004; Reed, 1995), et leur importance relative varie d’un marais à l’autre.
Dans des conditions idéales, les marais salés réagissent aux changements s’opérant le long des côtes, comme l’élévation du niveau de la mer, par la migration de leurs berges vers les terres (croissance horizontale) et l’accrétion (croissance verticale), ce qui permet, lorsque la quantité de sédiments disponibles est adéquate, de maintenir une élévation par rapport au niveau moyen de la mer appropriée pour la survie de la végétation (Butzeck et coll., 2015; French, 2019). La migration vers les terres est reflétée dans le compte de l’étendue, alors que les variations de l’élévation de la surface du marais découlant de l’accrétion ou de l’érosion sont reflétées dans le compte de la condition.
Tout changement ayant une incidence sur les processus qui sous-tendent l’accrétion, comme les changements dans l’approvisionnement en sédiments (p. ex. les répercussions négatives attribuables à la construction de structures de protection du littoral et à l’extraction de sédiments ou les changements positifs dus à l’augmentation de la production primaire), peut perturber l’équilibre des marais et influer sur leur topographie et leur hydrologie (Mudd, 2011; Schile et coll., 2014). Ces changements apportés à la fonction des marais de concert avec l’élévation accélérée du niveau de la mer peuvent entraîner une détérioration de la condition des marais ou une perte de leur étendue (Fitzgerald et Hughes, 2019).
La surface d’un marais peut également subir des changements localisés, comme l’expansion ou l’érosion à la lisière marine (Gabet, 1998; Houttuijn Bloemendaal et coll., 2021), ainsi que la migration ou le remplissage des chenaux et des marelles (Hughes et coll., 2009). L’expansion et l’érosion à la lisière marine sont prises en considération dans le compte de l’étendue, tandis que la migration et le remplissage des chenaux et des marelles sont reflétés dans le compte de la condition. De telles modifications des chenaux d’eau peuvent altérer la configuration du réseau de chenaux, ce qui a une incidence sur l’hydrologie des marais ainsi que sur leur accessibilité pour les poissons. Le suivi des variations de la surface des marais fournit des renseignements sur leur pérennité et peut permettre de détecter des changements dans leur fonctionnement écologique.
Des modèles altimétriques numériques (MAN), soit des modèles numérisés de la surface terrestre, sont nécessaires pour mesurer les variations de la surface des marais. Idéalement, les MAN devraient couvrir l’ensemble du littoral canadien et leurs données devraient être recueillies à long terme et périodiquement, en plus d’être d’une précision horizontale et verticale adéquate. Les MAN peuvent être générés à partir de données recueillies localement ou au moyen de données satellitaires. Les instruments de détection et télémétrie par ondes lumineuses (Hladik et coll., 2013), les radars à synthèse d’ouverture (RSO) et les radars interférométriques à synthèse d’ouverture sont particulièrement prometteurs pour la création de MAN et la mesure des variations de l’élévation de la surface des marais salés (Da Lio et coll., 2018). La production de MAN à l’échelle locale est un processus coûteux, mais ceux-ci sont généralement plus précis. Il est difficile de générer des MAN pour les marais salés à partir de données locales et satellitaires en raison des sols humides, de la densité de la végétation et des inondations intermittentes. En plus de la variation de l’élévation de l’ensemble de la surface du marais, plusieurs mesures de la configuration du réseau de chenaux peuvent être obtenues à l’aide des MAN, y compris, mais sans s’y limiter, la densité des chenaux ainsi que leur sinuosité (la mesure dans laquelle un chenal ou un réseau de chenaux est sinueux), lesquels peuvent être utiles pour évaluer la condition du marais.
Comme point de départ pour l’établissement des comptes écosystémiques, différentes options pour la création de renseignements sommaires sur l’élévation actuelle des marais salés sont en cours d’évaluation. Au fil du temps, l’obtention répétée de MAN permettra de mesurer le taux de variation spatialement explicite de l’élévation des marais, un paramètre plus utile pour l’évaluation de leur condition.
Mesures proposées :- Superficie totale dans les fourchettes d’élévation précisées
- Proportion de la superficie ou superficie totale des marais dont la variation de l’élévation se situe à l’extérieur des valeurs normales précisées au cours d’une période donnée
- Nombre de marais présentant une variation de l’élévation moyenne se situant à l’extérieur des valeurs normales précisées au cours d’une période donnée
- Variation moyenne de l’élévation (par unité de surface) par rapport à l’estimation locale de l’élévation du niveau de la mer
- Changement de la configuration du réseau de chenaux (p. ex. sinuosité, densité)
2.2.1.2 Hydrologie des marées
Dans les marais salés, l’hydrologie des marées (particulièrement les inondations) est intrinsèquement liée à la zonation des communautés végétales (Pennings et Bertness, 2001), à l’entrée des animaux dans le marais et à la préservation des milieux humides. Au chapitre des marais salés, trois caractéristiques de l’hydrologie des marées sont importantes : la durée des inondations (l’hydropériode), la fréquence des inondations et la profondeur des crues. Les changements à l’hydrologie des marais découlent des variations du niveau de la mer et de la construction ou du retrait de barrières intertidales qui bloquent ou altèrent les inondations (voir la section 2.2.6.1). L’augmentation de la durée, de la fréquence ou de la profondeur des inondations peut mener à la noyade de la végétation des marais, ce qui entraîne une perte de marais (sous l’effet de l’expansion des marelles ou de la conversion du marais en une vasière ou un habitat marin, entre autres) (Kirwan et coll., 2010) et une potentielle réduction des capacités de stockage et de séquestration de carbone en raison de la perte de végétation (Payne et coll., 2019). La diminution de la durée, de la fréquence ou de la profondeur des inondations peut entraîner une invasion de la végétation terrestre et provoquer la conversion d’un marais salé en habitat terrestre (p. ex. Smith et Warren, 2012). Dans ce dernier cas, un marais salé peut se transformer d’un puits de carbone en une source de carbone (McLeod et coll., 2011) à mesure que les sols deviennent plus oxygénés et que les taux de décomposition augmentent. Pour ces raisons, le suivi de l’hydrologie des marais aidera à déterminer dans quelles zones les communautés végétales et la fonction des marais sont altérées ou dans quelles zones on pourrait assister à une perte d’étendue.
Les caractéristiques de l’hydrologie des marées peuvent être mesurées à l’aide des données sur la hauteur des marées couplées à des MAN, de sorte à créer des modèles d’inondation simples. Il est possible de créer des mesures décrivant les inondations par la marée si l’on connaît la hauteur relative de la marée par rapport à la hauteur de la surface terrestre. Il est difficile de faire le rapprochement entre la hauteur des marées et l’élévation du sol, car leurs valeurs repères nulles diffèrent et varient également selon la région géographique. En principe, un modèle des marées continu sur le plan spatial dont on peut faire le rapprochement avec un système de référence géodésique est nécessaire pour produire des données significatives sur l’hydrologie des marées dans les marais salés à l’échelle nationale. En l’absence d’un tel modèle des marées, les données du Service hydrographique du Canada (SHC) pourraient être utilisées. Le SHC recueille des données sur la hauteur des marées dans un réseau limité de stations situées d’un bout à l’autre du Canada. Toutefois, il est difficile d’utiliser ces points de mesure dans un cadre spatialement explicite, car leur couverture spatiale n’est pas suffisante. De plus, les mesures sont habituellement effectuées en pleine mer, alors que les marais salés se forment dans les estuaires et le long des côtes abritées, où la force des marées peut être très différente. À l’heure actuelle, on explore les options pour la production de statistiques significatives sur l’hydrologie des marées à partir des données sur l’élévation du niveau de la mer.
Mesures proposées :- Proportion de la superficie ou superficie totale du marais inondée lorsque la hauteur des marées se situe dans des fourchettes précises
- Fréquence des inondations (pourcentage des marées hautes qui causent des inondations dans une proportion précise de la superficie du marais)
- Durée des inondations (nombre moyen de minutes pendant lesquelles une proportion précise de la superficie du marais est inondée par marée haute, par jour ou par une autre unité de temps)
- Durée (temps total, en minutes ou en jours, pendant laquelle une proportion précise de la superficie du marais est inondée au cours d’une période donnée, comme une année)
- Estimations de l’élévation du niveau de la mer au fil du temps
2.2.2 Condition chimique
Les variables de la condition chimique décrivent la composition chimique de diverses parties d’un écosystème (Nations Unies et coll., 2021). Les composantes chimiques importantes des marais salés sont la salinité du sol et de l’eau, ainsi que la concentration des polluants dans le sol et l’eau.
2.2.2.1 Salinité
La salinité est une des principales caractéristiques abiotiques liées à la structure et à la fonction des marais salés (Butzeck et coll., 2015; Pennings et Bertness, 2001). Les niveaux de salinité du sol varient d’un marais à l’autre et d’une partie de la surface d’un marais à une autre, et ce, en fonction de plusieurs facteurs, y compris : la salinité de l’eau de mer à l’endroit où se trouve le marais, la distance séparant le marais de la pleine mer, le niveau d’influence de l’eau douce, le renouvellement de l’eau par les marées, le type de sol, les taux d’évapotranspiration et les précipitations (Odum, 1988; Wang et coll., 2007). Bon nombre de ces facteurs sont influencés par les saisons.
Dans les marais salés, la salinité a une incidence sur les communautés végétales, la dynamique de concurrence et la productivité (Cooper, 1982; Pennings et coll., 2005). Les variations de la salinité peuvent également avoir des répercussions sur les fonctions des marais ou déclencher leur conversion en d’autres types d’habitats. Des recherches antérieures semblent également indiquer que les marais se trouvant dans les fourchettes de salinité inférieure et supérieure pourraient être touchés de façon disproportionnée par l’élévation du niveau de la mer (Craft et coll., 2009). Le suivi de la salinité fournira une indication de la pérennité du marais et des changements s’opérant dans sa fonction écologique, ce qui peut se révéler d’une importance particulière, étant donné que les changements climatiques ont une incidence sur les facteurs dont la salinité des marais est tributaire, y compris la salinité à la surface de la mer (Gulev et coll., 2021; Statistique Canada, 2021).
Les mesures de la salinité peuvent être prises in situ ou peuvent être modélisées. Des modèles de salinité des marais reposant sur certains des facteurs proposés au début de cette section pourraient être créés à l’avenir. Toutefois, en raison du manque de recherches sur ce sujet et de la complexité des processus sous-jacents de la salinité, cela n’est pas possible pour le moment. Les futures avancées dans le domaine de la modélisation fondée sur les données des RSO pourraient également se révéler prometteuses au chapitre de la mesure de la salinité du sol dans les marais salés (Taghadosi et coll., 2019). Pour le moment, les variations de la salinité à la surface de la mer et certaines variables climatiques connexes seront utilisées comme variables de substitution de la variation de la salinité des marais salés.
Mesures proposées :- Salinité de l’eau de mer adjacente au marais
- Salinité moyenne du sol dans chaque zone
- Variations des précipitations
2.2.2.2 Pollution
On sait que plusieurs polluants — des substances ayant un effet nocif sur l’environnement — ont une incidence négative sur les marais salés. Ces polluants comprennent, entre autres, les éléments nutritifs transportés dans les marais salés par le ruissellement d’eau douce provenant de zones bâties et de milieux agricoles (Cole et coll., 2006; McClelland et Valiela, 1998b), les hydrocarbures provenant de déversements de pétrole ainsi que les métaux lourds provenant de la sédimentation (DeLaune et coll., 1981) et des précipitations (Watmough et coll., 2017). Le sol des marais salés a la capacité d’emprisonner les polluants, y compris un certain nombre d’éléments nutritifs et de métaux, assurant ainsi d’importantes fonctions de filtration de l’eau (Reddy et coll., 2000; Valiela et coll., 1997). Toutefois, une augmentation des apports en polluants peut avoir des répercussions négatives sur la condition des marais salés.
La pollution par les éléments nutritifs modifie la communauté végétale (Levine et coll., 1998) et la croissance de la végétation (Langley et coll., 2013) dans les marais salés, car la croissance des plantes est habituellement limitée par la disponibilité de l’azote et du phosphore (Broome et coll., 1983; Kiehl et coll., 1997). Les marais riches en éléments nutritifs peuvent également être vulnérables à l’envahissement par des espèces exotiques (Gedan et coll., 2009) et produire moins de racines, ce qui entraîne l’érosion du sol (Turner, 2011). La végétation des marais salés peut aussi subir des répercussions indirectes et négatives dans les zones où les eaux marines sont riches en éléments nutritifs et dans les zones où des algues prolifèrent (Newton et Thornber, 2012; Wasson et coll., 2017).
Outre la pollution par les éléments nutritifs, les déversements d’hydrocarbures peuvent mener à des diminutions à long terme du couvert de végétation, ce qui entraîne des répercussions en cascade sur l’écosystème (Mendelssohn et coll., 2012). La présence de métaux lourds a une incidence directe plus faible, parce que la végétation des marais salés est tolérante à la toxicité des métaux (Nikalje et Suprasanna, 2018). Cependant, en tant que liens entre les bassins versants terrestres et l’environnement marin, les marais salés peuvent rejeter de la pollution par les métaux (Gedan et coll., 2009; Weis et Weis, 2004) et des éléments nutritifs (Page et coll., 1995) dans le réseau alimentaire marin. Ce processus a une incidence sur d’autres habitats côtiers et marins ainsi que sur les service d'approvisionnement des écosystèmes (McClelland et Valiela, 1998a; Valiela et coll., 2000). La quantification de la pollution joue un rôle important dans la compréhension de la condition des marais et des répercussions de la pollution sur les services écosystémiques, en plus d’être pertinente pour l’élaboration des politiques et la prise de décisions.
Puisque la pollution découle de l’activité humaine, il est possible de la mesurer en effectuant le suivi des apports de substances nocives dans l’environnement. Ainsi, pour mesurer cette variable de la condition des marais salés, on s’appuiera sur l’Inventaire national des rejets de polluants du Canada, une base de données visant à suivre les rejets de nombreux polluants environnementaux au moyen des déclarations obligatoires de certains types d’installations, ainsi que sur le Programme national de surveillance aérienne, qui surveille les déversements de pollution dans l’environnement marin. La liste des polluants qui feront l’objet d’une surveillance est fondée sur la littérature et l’opinion d’experts, et sera mise à jour au besoin. L’utilisation des terres et la condition de l’écosystème dans les zones entourant les marais salés pourraient être comprises dans cette variable, car elles peuvent avoir une incidence sur les apports de polluants (p. ex. présence et densité d’une zone tampon de végétation, rejet de polluants par une entreprise industrielle adjacente). Ces questions sont examinées plus en détail à la section 2.2.6.2.
Mesures proposées :- Charge de polluants par unité de surface provenant du ruissellement et de sources marines, selon le type de polluant
- Nombre cumulatif d’incidents de pollution au cours d’une période donnée (p. ex. l’année précédente ou les 10 années précédentes), selon le type de polluant, y compris la pollution marine et terrestre
- Mesures de prolifération des algues ou d’eutrophisation dans une unité de distance donnée
- Quantification de l’utilisation des terres avoisinantes lorsqu’il est impossible d’obtenir des mesures directes (voir la section 2.2.6.2)
2.2.3 Condition de la composition
Les variables de la condition de la composition décrivent les communautés des composantes biotiques (vivantes) d’un écosystème (Nations Unies et coll., 2021). Les composantes importantes des marais salés qui entrent dans cette catégorie sont les communautés végétales et la biodiversité animale.
2.2.3.1 Communauté végétale (espèces dominantes et envahissantes, zonation)
La végétation des marais salés joue un rôle majeur dans la prestation de nombreux services écosystémiques (Ngulube, 2021; Rabinowitz, 2020), favorise la biodiversité (Ziegler et coll., 2021) et est liée à la pérennité des marais au fil du temps (Cahoon et coll., 2020; Feagin et coll., 2009). Les communautés végétales sont des regroupements d’espèces végétales qui vivent ensemble dans un endroit donné. Dans un marais salé, les communautés végétales forment des modèles zonés parallèles à l’océan; chaque zone est dominée par une ou deux espèces, qui cohabitent avec d’autres espèces peu abondantes (Pratolongo et coll., 2019; Vince et Snow, 1984). Cette zonation est attribuable à la tolérance des espèces végétales à la salinité et aux inondations, et à leur capacité respective à rivaliser avec les autres espèces pour obtenir des ressources (Crain et coll., 2004; Pennings et coll., 2005). Ce modèle de zonation distinct est caractéristique de marais salés matures et sains.
Au Canada, on retrouve des marais salés sur toutes les côtes, et les espèces végétales indigènes qui y sont présentes varient grandement (MacKenzie et Moran, 2004; Martini et coll., 2019; Pratolongo et coll., 2019). La variabilité de la végétation indigène est liée aux différences sous-jacentes dans les conditions abiotiques (Crain et coll., 2004; Porter et coll., 2015). En raison de cette relation, les communautés végétales peuvent évoluer sous l’effet des changements climatiques (Colombano et coll., 2021).
Malgré les différences apparentes au chapitre des communautés végétales, les classifications écologiques regroupent habituellement les marais salés en un type unique d’écosystème (p. ex. Keith et coll., 2020). Peu de recherches ont été menées pour explorer si des différences en ce qui concerne la fonction écosystémique et l’offre de services écosystémiques des marais découlent de la variabilité des communautés végétales qui y sont présentes. Certaines études semblent indiquer que les espèces végétales locales et leurs structures communautaires ont des répercussions sur la capacité d’atténuation des vagues des marais salés (Schulze et coll., 2019; Vuik et coll., 2018) ainsi que sur leur utilisation par les poissons (Ziegler et coll., 2021). Il faudra davantage de renseignements sur ces différences pour interpréter l’incidence de la communauté végétale sur la condition de l’écosystème et les changements connexes s’opérant dans les services écosystémiques.
Idéalement, les données pour cette variable devraient être tirées d’une enquête sur la végétation des marais salés menée à l’échelle nationale — comme on l’a fait par exemple aux États-Unis (United States Geological Survey National Wetlands Research Center, s. d.; United States National Parks Service, s. d.) —, mais cela s’avèrerait une entreprise colossale. Une solution de rechange à envisager est l’utilisation de l’analyse multispectrale (Silvestri et Marani, 2004; Sun et coll., 2018) ou de l’analyse d’imagerie satellitaire par RSO (van Beijma et coll., 2014), lesquelles pourraient permettre d’identifier les modèles de zonation, que l’on pourrait utiliser comme mesure de substitution de la communauté végétale (Zhao et coll., 2019). L’utilisation de la télédétection a un inconvénient pratique : les variations des modèles de zonation peuvent ne pas toujours refléter les changements dans les espèces présentes dans les marais salés (p. ex. si une zone est entièrement repeuplée par une espèce envahissante, le nombre de zones demeurera inchangé). Cependant, une diminution à long terme du nombre de zones de végétation ou de la répartition de la superficie des zones pourrait indiquer la perte d’un marais salé ou que des changements y sont survenus. Par ailleurs, les centres de données sur la conservation pourraient fournir des données portant précisément sur les espèces rares ou en voie de disparition.
Bien que les espèces de plantes indigènes jouent un rôle essentiel dans la fonction des marais, des espèces de plantes envahissantes peuvent supplanter les espèces indigènes et, dans des cas extrêmes, envahir la totalité du marais (Gallardo et coll., 2015; Minchinton et coll., 2006). Cela provoque la dégradation de la condition de l’écosystème et une diminution de l’offre de services écosystémiques (Grout et coll., 1997; Warren et coll., 2001). Les marais en mauvais état peuvent être vulnérables aux invasions. Par exemple, les phragmites non indigènes (Phragmites australis ssp. australis) peuvent envahir les marais en mauvais état et riches en éléments nutritifs (Bertness et coll., 2002; Ravit et coll., 2007). Il existe un imposant corpus de recherches sur les répercussions négatives des phragmites sur les marais côtiers en Amérique du Nord (p. ex. Meyerson et coll., 2009; Weinstein et Balletto, 1999), mais il y a moins de recherches portant sur les autres espèces susceptibles d’envahir les marais salés en raison des conditions changeantes.
Plusieurs autres espèces de plantes aquatiques et de milieux humides envahissantes au Canada pourraient supplanter la végétation indigène des marais salés. Ces espèces envahissantes comprennent la salicaire pourpre (Lythrum salicaria), une espèce de milieu humide envahissante et agressive qui tolère l’eau saumâtre et qui est très répandue au Canada (Centre des espèces envahissantes, s. d.; Konisky et Burdick, 2005) et l’iris des marais (Iris pseudacorus), qui peuvent envahir les marais salés (Gerwing et coll., 2021; Sutherland et Walton, 1990). Sur la côte Ouest, plusieurs espèces agressives de Sporobolus (auparavant Spartina) originaires de la côte Est (Harney, 2008; Saarela, 2012), ainsi que la quenouille à feuilles étroites (Typha angustifolia) et la quenouille glauque (Typha x glauca) (Stewart, 2021) ont une incidence négative sur les marais salés. Selon le groupe de travail sur la biodiversité intitulé Conservation of Arctic Flora and Fauna, il y a peu d’espèces envahissantes dans l’Arctique à l’heure actuelle, mais on s’attend à ce que leur nombre augmente en raison des changements climatiques (Conservation of Arctic Flora and Fauna, 2013).
Aux fins de présentation des données sur les espèces envahissantes, il est possible de compiler une base de données à partir d’enregistrements sur la présence d’espèces envahissantes provenant des ensembles de données accessibles à la communauté internationale, comme le Système mondial d’informations sur la biodiversité (GBIF) — un ensemble d’enregistrements de sources multiples, y compris des herbiers et la science citoyenne du début du 20e siècle jusqu’à aujourd’hui. Il existe toutefois plusieurs limites à l’utilisation de ces données, entre autres parce que leur couverture spatiale et temporelle est biaisée. Les identifications issues de la science citoyenne peuvent également poser problème, car elles peuvent présenter un parti pris contre les espèces végétales moins attrayantes. Il faudra davantage de recherches pour parvenir à utiliser ces données efficacement dans les comptes sur les marais salés.
Mesures proposées :- Changement de la communauté végétale du marais au fil du temps, mesuré, par exemple, à l’aide d’un indice de diversité (p. ex. indice de Shannon), ou variation de la richesse des espèces
- Présence ou absence d’un modèle de zonation
- Nombre de zones distinctes
- Superficie de chaque zone
- Nombre d’occurrences individuelles d’espèces envahissantes dans une unité spatiale (p. ex. à l’intérieur des limites d’un marais, d’une zone tampon environnante, d’un estuaire)
- Nombre d’espèces envahissantes dans l’unité spatiale
2.2.3.2 Biodiversité animale (espèces indigènes et envahissantes)
Comme dans tout écosystème, la faune joue un rôle fonctionnel important dans les marais salés et peut être un indicateur de la condition de l’écosystème (Silliman et Bertness, 2002; Vivian-Smith et Stiles, 1994). Les marais salés sont fréquentés par un large éventail d’espèces; toutefois, puisque leur état passe en alternance de l’inondation à la sécheresse, la faune n’y est souvent que de passage. Les poissons et les crustacés peuvent occuper la surface du marais à marée haute, mais ils en ressortent avec la marée descendante (Ziegler et coll., 2021). À marée basse, de plus petits crustacés et poissons peuvent également se réfugier dans la boue humide ou les marelles, et peuvent jouer un rôle dans la modification des sols des marais salés (Able et coll., 2012; Pennings et Bertness, 2001). Les animaux terrestres fréquentent le marais à marée basse; par exemple, les oiseaux se nourrissent d’invertébrés dans le sol ou directement sur les plantes (Pennings et Bertness, 2001; Roberts et Robertson, 1986) et nichent dans les hauts marais. De plus, des pollinisateurs ont été observés dans les marais salés, quoique davantage de recherches doivent être menées pour comprendre comment les pollinisateurs utilisent cet écosystème (Roulston, 2021) (voir également la section 2.3.3.3, qui porte sur la pollinisation).
Les espèces animales envahissantes peuvent en revanche avoir une incidence négative sur les marais salés. Par exemple, la pervenche des marais (Littoraria irrorata) se nourrit des plantes des marais de la côte Atlantique Sud des États-Unis (Bertness et coll., 2004) et le crabe européen (Carcinus maenas) est responsable de l’érosion et de la perte de marais dans le Maine (Aman et Wilson Grimes, 2016). Toutefois, il y a peu ou pas de recherches sur ce sujet au Canada. Au fil du temps, l’acquisition de connaissances sur la biodiversité animale des marais facilitera la compréhension de la condition des marais.
Des indices de biodiversité pour les écosystèmes côtiers et marins ont été créés à partir d’ensembles de données mondiaux comme ceux de l’Union internationale pour la conservation de la nature (UICN) et du GBIF (Eddy et coll., 2021; Sievers et coll., 2021); toutefois, leur création requiert une énorme quantité de données et de ressources, ce qui limite leur répétabilité. À l’heure actuelle, on explore des façons de mesurer cette variable à l’échelle nationale.
De préférence, les mesures choisies prendront en compte l’abondance et la richesse de certaines espèces indigènes et envahissantes des marais salés. Leur élaboration nécessitera probablement une analyse documentaire visant à créer une liste exhaustive des espèces présentes dans les marais salés, à partir de laquelle il sera possible de déterminer les espèces à cibler, y compris : les espèces indicatrices, les espèces clés, les espèces d’une grande importance culturelle, les espèces importantes sur le plan économique, les espèces endémiques, les espèces en péril et les espèces spécialistes. L’élaboration des données reposera sur des ensembles de données provenant de sources mondiales (p. ex. l’UICN), des administrations provinciales et territoriales, du gouvernement fédéral (p. ex. Pêches et Océans Canada, Environnement et Changement climatique Canada ainsi que Parcs Canada), d’universités et d’organisations non gouvernementales (p. ex. les centres de données sur la conservation).
Des données peuvent également être tirées de bases de données de science citoyenne comme eBird et le GBIF, quoiqu’elles doivent faire l’objet d’une évaluation et d’un traitement supplémentaires en raison des biais qu’elles comportent. Une mesure de substitution de la biodiversité associée aux marais salés est en cours d’élaboration; elle intègrera des données d’enquête, des données de science citoyenne et des données de télémétrie. L’utilisation d’autres approches, comme la technologie émergente de l’ADN environnemental (ADNe) (Thomsen et Willerslev, 2015; University of New Hampshire, National Estuarine Research Reserve System, s. d.), nécessiterait davantage de recherches et la mise sur pied de programmes de surveillance.
Mesures proposées :- Indice de biodiversité pour les espèces animales qui utilisent les marais salés et qui ont une aire de répartition connue se trouvant à une distance précise d’un marais salé, cet indice prenant en compte les renseignements sur l’importance des habitats de marais salés pour ces espèces, leur état de conservation et leur importance (p. ex. espèces clés)
- Nombre d’occurrences individuelles d’espèces clés, indicatrices, rares ou en voie de disparition ou autrement importantes dans une unité spatiale (p. ex. à l’intérieur des limites d’un marais, d’une zone tampon environnante, d’un estuaire)
- Nombre d’occurrences individuelles d’espèces envahissantes dans une unité spatiale (p. ex. à l’intérieur des limites d’un marais, d’une zone tampon environnante, d’un estuaire)
- Nombre d’espèces envahissantes dans une unité spatiale
2.2.4 Condition structurelle
Les variables de la condition structurelle permettent de décrire les propriétés de l’écosystème dans son ensemble, ou de ses principales composantes biotiques (Nations Unies et coll., 2021). Au chapitre des marais salés, la condition structurelle de la végétation est la variable la plus importante.
2.2.4.1 Structure de la végétation (densité des tiges, biomasse)
La végétation des marais salés forme des modèles zonés où chaque zone est dominée par une ou deux espèces tolérantes au sel et aux inondations. Ces plantes croissent en une végétation dense et très productive (Serrano et coll., 2019). La structure physique de la végétation (p. ex. la densité des tiges et la biomasse) soutient le fonctionnement de l’écosystème (p. ex. Cahoon et coll., 2020; Kearney et Fagherazzi, 2016) et l’offre de services écosystémiques.
La structure physique de la végétation des marais salés est associée à l’atténuation des vagues (Möller et coll., 2014), à la protection du littoral (Shepard et coll., 2011) et à la fréquentation des marais par les poissons (Whitfield, 2017; Ziegler et coll., 2021). La structure de la végétation joue également un rôle dans la séquestration du carbone (Serrano et coll., 2019; Tobias et Neubauer, 2019) et dans l’accrétion (Gleason et coll., 1979; Mudd et coll., 2010), car le carbone organique (emprisonné par photosynthèse dans la matière végétale) et le carbone inorganique (sédiments piégés sur les tiges des plantes) sont incorporés aux sols des marais au fil du temps. Les matières végétales mortes sont également rejetées dans les milieux littoraux par les marées descendantes, fournissant des éléments nutritifs aux espèces qui sont les proies des poissons importants sur le plan commercial (Jänes et coll., 2020; Valiela et coll., 2000). Les changements dans la structure de la végétation des marais salés qui découlent des changements climatiques ou d’autres pressions extérieures sont susceptibles d’avoir une incidence sur ces processus et, éventuellement, pourraient entraîner une perte d’étendue ou de l’offre de services écosystémiques.
Des indices de végétation, tels que l’Indice de végétation par différence normalisé (IVDN) — qui représente la « verdure » d’une zone en imagerie) —, sont couramment utilisés pour déterminer les zones végétales et mesurer des caractéristiques comme la biomasse et la densité des tiges (Eastwood et coll., 1997; Xue et Su, 2017). Ils sont simples à calculer à l’aide de technologies largement accessibles, comme l’imagerie satellitaire ou d’autres techniques d’imagerie aérienne (p. ex. Ghosh et coll., 2016). Toutefois, les inondations par la marée, les eaux stagnantes peu profondes et les sols nus dans les marais salés, ainsi que les variations spatiales et temporelles de ces caractéristiques, peuvent avoir une incidence sur les calculs (Kearney et coll., 2009; Xue et Su, 2017). Des auteurs ont mesuré la structure de la végétation dans les marais salés avec succès au moyen de l’IVDN (Hardisky et coll., 1984; Lopes et coll., 2020), mais des indices de végétation moins sensibles à la réflexion de l’eau et des sols ont également été utilisés. Ceux-ci comprennent l’indice modifié de végétation ajusté pour le sol, l’indice de végétation zonale (Eastwood et coll., 1997) et l’indice de végétation à large plage dynamique (Ghosh et coll., 2016; Gitelson, 2004), entre autres (Miller et coll., 2019). Certains de ces indices ne peuvent pas être mesurés avec tous les types de technologies d’imagerie de télédétection.
Parmi les autres options pour mesurer ou modéliser la biomasse aérienne ou la hauteur de la végétation des marais salés, on retrouve l’utilisation des MAN et des modèles numériques de surface (MNS), des modèles de la surface terrestre qui montrent, entre autres, la végétation et les bâtiments. En effet, il est possible de connaître la hauteur de la végétation en soustrayant un MAN créé en début de saison à un MNS enregistré lorsque la biomasse est à son apogée. On a également employé les RSO pour estimer la quantité de la biomasse aérienne avec un succès relatif dans les milieux humides côtiers (Jensen et coll., 2019).
Dans les marais salés en particulier, l’obtention de données ayant une résolution spatiale qui permet de relever les dimensions, la forme et les modèles de zonation de la végétation des marais salés pose un problème supplémentaire. La production de biomasse et les caractéristiques de la végétation, par exemple, peuvent varier d’une espèce végétale à l’autre (Miller et coll., 2019; Mo et coll., 2018), varier au sein d’une même espèce et varier d’une partie de la surface du marais à une autre (Kirwan et coll., 2009; Tobias et Neubauer, 2019). Des recherches antérieures semblent indiquer que le fait de mesurer les caractéristiques structurelles de la végétation par imagerie satellitaire sans prendre en compte les modèles de zonation de la végétation peut être efficace à grande échelle (Ghosh et coll., 2016). Un autre facteur à prendre en considération est que les indices de végétation peuvent atteindre un point de saturation lorsque la densité de la végétation est élevée (Gitelson, 2004), comme dans un marais salé. Cependant, l’utilisation d’un ou de plusieurs indices de végétation est susceptible de donner une indication raisonnable de la structure de la végétation d’un marais salé. À l’heure actuelle, on utilise Google Earth Engine pour calculer et comparer plusieurs indices de végétation à partir de l’imagerie Sentinel-2 afin de faire état de cette variable de la condition. Au fil du temps, des mesures plus précises de la structure de la végétation, telles que la biomasse, pourraient être produites au moyen d’efforts de modélisation ou de techniques reposant sur des instruments multiples (Lumbierres et coll., 2017; Mo et coll., 2018). En outre, les comptes initiaux comprendront également des variables climatiques ayant des répercussions sur la productivité des plantes, comme la température et les précipitations (Charles et Dukes, 2009; Kirwan et coll., 2009).
Mesures proposées :- Superficie totale dans des fourchettes de l’indice de végétation précises au cours d’une période donnée
- Proportion de la superficie ou superficie totale du marais dont la variation de l’indice de végétation se trouve à l’extérieur d’une fourchette de valeurs normales précise au cours d’une période donnée
- Nombre de marais présentant une variation de l’indice de végétation moyen se situant à l’extérieur d’une fourchette de valeurs normales précise au cours d’une période donnée
- Degrés-jours de croissance
- Hauteur de la végétation
2.2.5 Condition fonctionnelle
Les variables de la condition fonctionnelle décrivent les interactions entre les différentes composantes d’un écosystème (Nations Unies et coll., 2021). Pour les marais salés, cela comprend la description des perturbations.
2.2.5.1 Perturbations (varech, glace, herbivorisme)
Les perturbations naturelles font partie intégrante du développement et de la pérennité des marais salés. Plus précisément, les perturbations causées par le varech (tapis de débris végétaux), l’herbivorisme (consommation de végétaux par les animaux) et la glace (formée dans le marais ou l’océan) sont courantes dans les marais salés. Le varech et la glace jouent un rôle important dans l’accrétion (Argow et coll., 2011; Dionne, 1993) et la dynamique de la végétation (Ewanchuk et Bertness, 2003; Rabinowitz et coll., 2022), et façonnent la topographie des marais salés (Dionne, 1969). L’accumulation de glace peut également protéger la lisière marine des marais salés contre l’érosion causée par les vagues. L’ampleur, la durée et la nature des perturbations liées à la glace et au varech peuvent changer sous l’effet des changements climatiques, puisqu’il s’agit de processus saisonniers. C’est pourquoi il est pertinent d’en faire le suivi pour la production des comptes de la condition.
Les marais salés sont également sujets à l’herbivorisme, en particulier par les oies. Il a été démontré que l’herbivorisme des oies modifie considérablement les marais salés qui se trouvent le long de la baie d’Hudson et de la côte Ouest du Canada en raison des changements survenant dans le comportement et la taille de la population des oies au fil du temps (Dawe et coll., 2015; Jefferies et coll., 2006). La pression exercée par l’herbivorisme est susceptible d’évoluer sous l’effet des changements climatiques et de l’introduction continue d’espèces non indigènes, ce qui pourrait avoir des répercussions sur la condition des marais salés.
On dispose de données sur la couverture de glace de mer à l’échelle nationale, mais il existe peu ou pas de données sur les autres pressions décrites ici. Des données climatiques, comme la température et la durée de la saison des glaces, fourniront des renseignements supplémentaires sur les événements liés à la glace pouvant causer des perturbations dans les marais salés. Toutefois, les méthodes de suivi du varech et de l’herbivorisme n’ont pas encore été explorées. La télédétection pourrait être utilisée à l’avenir pour recueillir des données sur ces types de perturbations dans les marais salés (p. ex. Jefferies et coll., 2006), mais cette variable fera l’objet de davantage de recherche à mesure que les comptes seront élaborés, particulièrement en ce qui a trait à la relation entre la présence des agents perturbateurs et leurs répercussions réelles.
Mesures proposées :- Zone touchée par des perturbations, selon le type de perturbation
- Nombre d’événements par année, selon le type de perturbation
- Nombre de jours sous une température de 0° C
- Taille des populations d’oies ou d’autres herbivores
2.2.6 Paysages terrestres et marins
Les variables des paysages terrestres et marins fournissent des renseignements sur les écosystèmes à une échelle spatiale générale, et peuvent comprendre des renseignements sur les terres avoisinantes. Cette section porte sur les barrières et les restrictions intertidales, l’utilisation des terres avoisinantes et la configuration des marais salés à l’échelle du paysage.
2.2.6.1 Barrières et restrictions intertidales
Il y a longtemps que les humains érigent des infrastructures matérielles le long des côtes, comme des murs de protection, pour protéger les établissements côtiers et lutter contre l’érosion côtière; toutefois, ces infrastructures côtières peuvent être dommageables pour les environnements adjacents. Les infrastructures côtières peuvent être construites à toute distance de la lisière marine, selon sa fonction (p. ex. des ponts-jeté ou des digues à la lisière terrestre, et des murs de protection ou des revêtements à la lisière marine). Elles peuvent également être érigées dans l’eau (p. ex. les brise-lames, qui assurent la protection contre les vagues). Ces constructions peuvent provoquer la perte de marais salés si elles sont érigées sur ce dernier ou si elles limitent ou empêchent les inondations par la marée (comme c’est le cas des digues ou des ponceaux mal dimensionnés, entre autres), ce qui peut mener à la conversion partielle ou entière du marais salé en habitat terrestre ou d’eau douce (Heery et coll., 2017; Smith et Warren, 2012). La conversion des marais salés en milieux terrestres, qui peuvent ensuite être utilisés à d’autres fins, telles que l’agriculture, est une des principales causes de la perte des marais littoraux au Canada (Bowron et coll., 2012; Gedan et coll., 2009). De plus, les infrastructures (p. ex. les routes, les aménagements du littoral) peuvent faire obstacle à la migration des marais salés vers les terres, c’est-à-dire qu’elles limitent l’adaptabilité naturelle des marais à l’élévation du niveau de la mer — ce qu’on appelle la « compression côtière » (Doody, 2004) —, peuvent éliminer les habitats de transition aux lisières terrestre et marine d’un marais, et peuvent contribuer à la fragmentation de l’habitat à l’échelle du paysage (Dugan et coll., 2011; Leo et coll., 2019).
On sait également que les infrastructures érigées le long des côtes ont des répercussions sur la condition des marais salés avoisinants. Les infrastructures côtières ont une incidence sur les processus naturels d’érosion et de sédimentation côtières, ainsi que sur l’hydrologie à l’échelle locale et du paysage, ce qui peut entraîner la dégradation et la perte de marais salés (Bozek et Burdick, 2005; Dugan et coll., 2011). Les travaux de construction le long des côtes peuvent également introduire des espèces envahissantes dans les marais salés (Currin, 2019).
Ces répercussions amènent toutes des changements bien documentés dans le comportement des animaux (Klein et coll., 2011; Peterson et Lowe, 2009) et des diminutions de la biodiversité côtière et littorale, ce qui a une incidence négative sur la flore et la faune des marais salés (Partyka et Peterson, 2008; Peterson et coll., 2000). Ces répercussions sur l’étendue et la condition des marais salés, et les liens directs qu’elles ont avec les politiques et la prise de décisions font des barrières et des restrictions intertidales une importante variable de la condition à inclure dans les comptes sur les marais salés.
À l’heure actuelle, on procède au regroupement des ensembles de données existants qui indiquent les emplacements des infrastructures côtières. À l’avenir, il serait utile d’intégrer aux présents travaux une évaluation des restrictions intertidales (emplacement et degré de restriction) et un registre des nouvelles constructions ayant une incidence sur les milieux humides côtiers, ainsi que des renseignements détaillés sur les zones touchées par des barrières existantes ou nouvelles. Puisque les infrastructures côtières peuvent avoir une incidence sur les marais salés à l’échelle du paysage, des limites spatiales appropriées sont nécessaires pour mesurer cette variable. De plus, on pourrait envisager des infrastructures côtières « vertes » ou « hybrides », qui mettent à profit les écosystèmes naturels (p. ex. des marais salés construits) ou qui associent des éléments écologiques à des éléments matériels conventionnels pour assurer la protection des régions côtières (Currin, 2019; Sutton-Grier et coll., 2015).
Mesures proposées :- Nombre de barrières intertidales et leurs degrés de restriction intertidale (partielle ou complète) au sein d’une unité spatiale
- Nombre ou longueur et type d’infrastructure côtière dans une zone tampon entourant un marais ou une unité spatiale plus vaste
- Superficie du marais salé touché se trouvant derrière la barrière ou la restriction intertidale
- Quantification de l’utilisation des terres avoisinantes quand il est impossible d’obtenir des mesures directes (section 2.2.6.2)
2.2.6.2 Utilisation des terres avoisinantes
L’utilisation des terres qui entourent les marais salés est associée à plusieurs pressions sur la condition des marais. Comme il a été mentionné à la section 2.2.6.1, les barrières intertidales et les infrastructures côtières créent des obstacles à la migration naturelle des marais salés vers les terres en tant que mécanisme d’adaptation à l’élévation du niveau de la mer, et peuvent entraîner une érosion excessive, avoir une incidence sur la dynamique côtière et limiter la connectivité des habitats (Dugan et coll., 2011; Peterson et Lowe, 2009).
Les zones bâties et les terres utilisées à des fins agricoles sont associées à la pollution et aux invasions d’espèces exotiques (King et coll., 2007; Silliman et Bertness, 2004), comme il a été mentionné à la section 2.2.2.2 et la section 2.2.3.1 Elles peuvent également contribuer à la perte de marais salés pris en étau entre la mer, dont le niveau monte, et les zones bâties (Leo et coll., 2019). Les zones bâties et les terres utilisées à des fins agricoles avoisinantes peuvent également avoir une incidence sur la végétation, la salinité et l’hydropériode des marais, ainsi que sur la nappe phréatique (Álvarez-Rogel et coll., 2007). Par ailleurs, elles sont associées à une diminution de la diversité et de l’abondance de la faune (King et coll., 2005; Morley et coll., 2012). Pour ces raisons, les marais salés entourés de paysages modifiés par l’homme sont plus susceptibles d’être en mauvaise condition et de voir leur offre de services écosystémiques être modifiée.
La première version de cette variable sera mesurée au moyen des ensembles de données existants sur l’utilisation des terres et la couverture terrestre à l’échelle nationale ou mondiale (p. ex. Agriculture et Agroalimentaire Canada, 2018; Statistique Canada, 2021). Pour cette variable, des calculs simples de la superficie pour diverses catégories de couverture terrestre (p. ex. zones naturelles, bâties, agricoles, mixtes) à une distance précise des limites des marais salés seront effectués.
Mesures proposées :- Superficie ou proportion de la superficie d’utilisation des terres dans une unité spatiale (p. ex. à l’intérieur des limites d’un marais, d’une zone tampon environnante, d’un estuaire), selon le type d’utilisation
- Longueur du nombre moyen de routes dans une unité spatiale, selon la classification (autoroute, route locale, etc.)
- Distance par rapport à l’infrastructure la plus près
- Densité de la population dans une zone tampon spatiale
2.2.6.3 Configuration du paysage
La configuration du paysage désigne la configuration spatiale des parcelles de marais à l’échelle locale et du paysage. Cette configuration peut avoir une incidence sur la condition des marais et l’offre de services écosystémiques. La forme, la taille, la longueur de la lisière marine du marais, ainsi que son emplacement relatif le long de la côte, font tous partie de la configuration du paysage et peuvent tous avoir une incidence sur le fonctionnement du marais (p. ex. French, 2019; Wu, 2019). La lisière marine est un habitat particulièrement important, car elle fait la jonction entre le marais et l’environnement marin (Minello et coll., 1994; Ziegler et coll., 2021). De plus, il a été démontré que les marais situés à une plus grande proximité d’autres habitats marins intacts, y compris d’autres marais, abritent une plus grande biodiversité animale (Litvin et coll., 2018; Partyka et Peterson, 2008). La configuration du paysage est également associée à la capacité d’adaptation des marais salés à l’élévation du niveau de la mer (Wu, 2019).
Il est possible de mesurer la configuration du paysage en effectuant des calculs spatiaux relativement simples dans un logiciel de système d’information géographique fondé sur des données sur l’étendue. L’une des principales difficultés liées à cette méthode est que les ensembles de données sur l’étendue actuels ne reflètent pas fidèlement les chenaux de marée (habitat de lisière) dans les marais salés; ceci devra être pris en considération avant de réaliser ces analyses. À l’avenir, d’autres mesures de la configuration du paysage pourraient également être produites à l’aide de logiciels comme Fragstats (McGarigal et Marks, 1995), qui analyse l’imagerie aérienne pour déterminer les configurations spatiales.
Mesures proposées :- Taille moyenne des marais dans une unité spatiale
- Distance moyenne jusqu’au marais le plus près dans une unité spatiale
- Rapport superficie-lisière
- Mesure de la connectivité (p. ex. indice de connectivité dans Fragstats)
2.2.7 Condition de référence
Dans le SCEE-CE, il est recommandé de créer une condition de référence des écosystèmes à titre de point de comparaison pour déterminer la condition relative au fil du temps (Nations Unies et coll., 2021). Cette condition de référence devrait correspondre à la condition « idéale » ou « saine ». Habituellement, on crée la condition de référence à partir de la condition des marais à un point précis dans le temps ou de la condition des marais dans une zone en grande partie non modifiée par l’homme. Dans le cas des marais salés, cela est une tâche complexe pour plusieurs raisons.
Dans l’Est canadien, les marais salés comptent parmi les premières terres modifiées par les colons. Au fil du temps, les marais salés ont été creusés, drainés, pâturés par le bétail et autrement détruits partout en Amérique du Nord (Bertness et coll., 2004). Dans certains cas, ces modifications perdurent, et dans d’autres, elles ont été abandonnées. Les marais salés peuvent se reconstituer dans les zones où les modifications ont été abandonnées, mais leurs fonctions peuvent être altérées en raison de modifications antérieures. Il devient alors difficile de trouver des marais de référence n’ayant pas été modifiés ou des marais dont la condition est demeurée inchangée pendant suffisamment longtemps pour revenir à leur état naturel, d’autant plus que de manière générale, les données sur les marais salés sont rares.
Il existe moins de données sur les marais salés dans les régions éloignées du Canada, dont l’Arctique, où l’étendue des marais salés est probablement plus importante que ce que la cartographie actuelle nous apprend. Ce biais géographique complique la détermination des conditions de référence ou la localisation des marais de référence à l’échelle du pays, en particulier en raison de la variation inhérente des caractéristiques, telles que la salinité, à l’échelle du pays. D’autres variations des caractéristiques du marais à des échelles spatiales plus petites (dans un marais, dans un estuaire) font qu’il est encore plus difficile d’adopter des valeurs de référence reflétant ces nuances.
À l’heure actuelle, les données sur les marais salés protégés depuis au moins 10 ans seront utilisées pour déterminer les conditions de référence, en mettant l’accent sur les marais historiquement non modifiés, dans la mesure du possible. Le Canada dispose d’une base de données spatialement explicites sur les marais salés protégés qui est relativement vaste et qui comprend des zones de marais protégés dans la plupart des régions du pays, ce qui permettra d’effectuer des comparaisons géographiques explicites de la condition des marais salés. Ces marais fourniront une mesure se rapprochant autant que possible de la condition « naturelle » des marais salés. Une des limites de cette méthode est que les changements climatiques ont déjà eu des répercussions sur les marais salés. Lorsqu’on disposera de meilleures données sur l’étendue, il est possible que l’on doive employer une nouvelle méthode de mesure de la condition de référence dans les régions où on manque présentement de données.
2.3 Services écosystémiques
Les services écosystémiques sont définis de façon générale comme les contributions de l’écosystème aux avantages que les humains tirent de l’environnement. La comptabilisation des services écosystémiques est un élément clé du cadre du SCEE-CE (Nations Unies et coll., 2021), car ce processus permet de relier l’étendue et la condition des écosystèmes à leur capacité de fournir des services sur lesquels les humains comptent. Les écosystèmes plus sains fournissent davantage de services que les écosystèmes en mauvais état ou dégradés.
Le cadre du SCEE-CE permet de classer les services écosystémiques en trois grands groupes : services d’approvisionnement, services de régulation et de maintien, et services culturels (Nations Unies et coll., 2021). Les services sont fournis par les écosystèmes et ont un bénéficiaire. Le bénéficiaire peut être une population locale ou la population mondiale, ou encore, un autre écosystème. Les services qui contribuent au bien-être humain sont des services finaux, tandis que ceux qui profitent à d’autres écosystèmes ou espèces sont des services intermédiaires ou complémentaires.
Dans la section suivante, on présente les services écosystémiques fournis par les marais salés, accompagnés de leurs descriptions ainsi que de possibles sources de données et méthodes de mesure. Les chaînes logiques qui décrivent les intrants, les bénéficiaires et l’utilisation de chaque service sont présentées dans le tableau 3. Plusieurs de ces services sont difficiles à mesurer directement et, en pareil cas, l’utilisation de méthodes de substitution est examinée. La mesure de certains services nécessite l’élaboration d’une méthodologie ou des données qui ne sont pas actuellement disponibles; les comptes initiaux comprendront par conséquent des lacunes en matière de données.
Les services peuvent être mesurés à la fois sur le plan physique (p. ex. les débarquements de produits de la pêche, en tonnes) et sur le plan monétaire (p. ex. les débarquements de produits de la pêche mesurés selon la valeur en dollars des ventes) (Nations Unies et coll., 2021). Les valeurs monétaires sont utilisées pour établir des liens avec les décisions politiques et le système de comptes nationaux. Le présent document, toutefois, porte principalement sur les mesures physiques des services, lesquelles reposent uniquement sur des méthodes monétaires quand il est impossible d’obtenir des données sur les flux physiques. Les évaluations monétaires des services seront élaborées à une étape ultérieure, en gardant à l’esprit qu’elles changeront non seulement en raison des changements écosystémiques, mais aussi de la variabilité de l’économie.
Figure 2
Description de la figure 2
La figure s’intitule « Services écosystémiques des marais salés ». Elle comporte une grande image ainsi que trois encadrés dans la partie supérieure qui contiennent des explications sur les principaux services et avantages de l’écosystème.
Le contenu des encadrés est le suivant :
- Les services d’approvisionnement : Récolte d’aliments dans la nature. Récolte à des fins médicinales et culturelles.
- Les services de régulation : Régulation du climat. Protection contre l’érosion et les inondations côtières. Protection contre l’élévation du niveau de la mer. Purification de l’eau. Fourniture d’habitats. Pollinisation.
- Les services culturels et les services non liés à l’utilisation : Éducation. Loisirs et tourisme. Spiritualité et sentiment d’appartenance. Services non liés à l’utilisation.
L’image présente un panorama ombré, où l’on distingue une collectivité au loin. Dans la moitié inférieure de l’image, on retrouve la zone du marais, qui est en couleur. Le long de la rive et dans le marais, il y a une épaisse végétation, avec de nombreuses variétés d’herbes et des oiseaux. On peut aussi voir des poissons nager.
2.3.1 Services d’approvisionnement (récolte d’espèces sauvages, matières premières)
Les services d’approvisionnement découlent de l’extraction ou de la récolte de biomasse des écosystèmes. C’est la manière la plus évidente dont les personnes tirent avantage des écosystèmes qui les entourent. Les récoltes d’aliments, de matières premières, d’ingrédients médicinaux et d’éléments culturels ou décoratifs appartiennent à la catégorie des services d’approvisionnement et peuvent être mesurées selon la quantité physique de matériel extrait (y compris tous les déchets).
Plusieurs espèces comestibles, tant végétales qu’animales, sont récoltées dans des marais salés partout au Canada. La salicorne (Salicornia spp.), qui porte d’autres noms courants comme le cornichon de mer, l’asperge de mer ou la corne salée, est récoltée dans des marais salés partout au monde. On la trouve occasionnellement dans des épiceries, des marchés communautaires, des magasins d’alimentation spécialisés en ligne et certains restaurants en saison (Clapson, 2014). Le plantain maritime (Plantago maritima), l’arroche (Atriplex spp.) et le laiteron (Sonchus spp.) sont également récoltés à des fins alimentaires dans les marais salés du Canada (Cohen, 2018). De plus, le trèfle de Wormskjöld (Trifolium wormskioldii) et la potentille des rivages (Potentilla egedii) étaient des légumes-racines traditionnellement récoltés dans les marais salés par les membres des Premières Nations, y compris les Nuu-chah-nulth et les Kwakwaka’wakw. Ces Premières Nations étaient connues pour gérer les marais salés de sorte à augmenter le rendement de ces plantes (Turner et coll., 2013).
On se livre aussi fréquemment à la pêche récréative, à la pêche des palourdes et à la chasse à la sauvagine et au gibier à plume dans les marais salés (Environnement et Changement climatique Canada, 2020; Environnement et Changement climatique Canada, 2021). Autrefois, la Première Nation mi’kmaq recueillait des mollusques et des crustacés dans les marais salés, comme le montrent des amoncellements de restes de bigorneaux et autres mollusques et crustacés (Nova Scotia Museum, 2020).
Des plantes des marais salés sont également récoltées à des fins autres que l’alimentation, y compris à des fins médicinales, culturelles ou décoratives. Le foin d’odeur (Anthoxanthum spp.), une plante extrêmement importante pour de nombreuses cultures autochtones au Canada, pousse dans des marais salés partout au pays (Tiner, 2009). Les Mi’kmaq récoltent le foin d’odeur dans les marais salés de la côte Est à des fins médicinales, de même que le limonium de Caroline (Limonium carolinianum) et les quenouilles (Typha spp.) (Sherren et coll., 2021). Les feuilles et les tiges de quenouille servent à fabriquer un certain nombre d’objets, allant des paniers et des sacs jusqu’à du papier et du tissu, tandis que le limonium de Caroline est récolté pour créer des arrangements floraux (Baltzer et coll., 2002).
Il est difficile de faire le suivi de l’ensemble des récoltes de produits alimentaires et de matières, car ces récoltes sont souvent des activités de subsistance et la vente des produits qui en découlent est restreinte. En tant qu’article de spécialité, le prix de la salicorne variait de 12 $ à 20 $ la livre en 2015 (Langford, 2015), et des prix semblables ont été observés dans des magasins en ligne en 2022. On recueille des données sur les ventes de salicorne dans les épiceries canadiennes, mais il n’est pas possible de publier leur valeur en raison des exigences de confidentialité. Les autres aliments récoltés dans les marais salés sont rarement vendus dans les épiceries, ce qui complique la collecte de données sur les ventes. Les enquêtes actuelles sur la pêche récréative ne permettent pas d’obtenir les données nécessaires, car les renseignements sur l’emplacement précis des prises ne sont pas recueillis, compliquant le couplage des données à un écosystème en particulier. Les récoltes à des fins médicinales et culturelles sont également très difficiles à mesurer.
À l’avenir, il pourrait être possible de mesurer l’approvisionnement en espèces sauvages des marais salés et d’autres écosystèmes en utilisant l’approche participative, des enquêtes sur les habitudes de recherche de nourriture et la mobilisation des Autochtones. Pour ce qui est de la recherche de nourriture et de la pêche, la collecte d’images étiquetées et géolocalisées sur les médias sociaux pourrait servir à déterminer quels marais salés sont utilisés à des fins d’approvisionnement. Toutefois, l’utilisation de données obtenues par approche participative ou tirées des médias sociaux comporte des risques inhérents au biais de participation.
Mesures proposées :- Biomasse récoltée
- Ventes de plantes récoltées ou d’animaux recueillis
- Approche participative ou enquête permettant d’établir la biomasse récoltée à des fins d’approvisionnement
- Nombre de publications de médias sociaux géolocalisées portant sur des activités de récolte dans les marais salés
2.3.2 Régulation
Les services de régulation et de maintien dépendent de la capacité de l’écosystème à influer sur les processus biologiques, le climat ainsi que les cycles hydrologiques et biochimiques, et de les réguler pour préserver sa condition environnementale (Nations Unies et coll., 2021). Les marais salés fournissent ces services en abondance, ce qui profite aux bénéficiaires à l’échelle locale et mondiale. Ce groupe de services comprend, entre autres : la régulation du climat, la protection contre les inondations côtières et le contrôle de l’érosion.
2.3.2.1 Régulation du climat
L’évaluation du rôle des marais salés dans la régulation du climat mondial par le stockage et la séquestration du carbone n’a été menée que récemment. La structure dense des racines et la lente vitesse de décomposition des matières organiques dans les marais salés font de ces derniers des milieux propices au stockage du carbone à long terme (Connor et coll., 2001). Selon les taux moyens mondiaux de séquestration du carbone (McLeod et coll., 2011), les écosystèmes canadiens connus des marais salés peuvent séquestrer jusqu’à 785 kilotonnes de carbone par année.
La capacité de stockage et de séquestration du carbone (le processus par lequel le carbone est capté) varie considérablement d’un marais à l’autre, car les communautés végétales varient au sein d’un même marais salé et d’un marais salé à l’autre (voir la section 2.2.3.1). Par conséquent, dans les comptes, le stockage et la séquestration du carbone seront présentés au moyen d’estimations régionales, dans la mesure du possible (p. ex. la baie Clayoquot [Chastain, 2017], la Boundary Bay [Gailis et coll., 2021] et la baie de Fundy [Connor et coll., 2001]). À mesure que les comptes seront élaborés, des plateformes de modélisation des services écosystémiques et d’autres techniques de modélisation plus sophistiquées fondées sur des données nationales seront utilisées pour enrichir ces simples estimations régionales.
Les marais salés fournissent également des services de régulation du microclimat, puisque grâce à l’évapotranspiration, ils ont une incidence sur les conditions météorologiques locales (Nations Unies et coll., 2021). Toutefois, comme les marais salés sont habituellement situés près de zones en pleine mer, on s’attend à ce que leur incidence sur le climat local soit mineure par rapport à celle de l’océan. Les marais salés situés le long de rivières saumâtres et aux extrémités des fjords pourraient jouer un rôle plus important dans le microclimat, mais cela ne constitue qu’un futur axe de recherche pour le moment.
Mesure proposée :- Taux de séquestration et de stockage du carbone, mesurés ou modélisés, multipliés par la superficie
2.3.2.2 Protection contre les inondations côtières
On s’attend à ce que les inondations côtières causées par les ondes de tempête soient exacerbées par l’augmentation de la fréquence et de l’intensité des tempêtes au cours du présent siècle (Lemmen et coll., 2016), ce qui constitue un risque pour les collectivités et les infrastructures côtières, ainsi que pour les terres économiquement rentables à l’intérieur des zones côtières. Des études récentes ont révélé que les marais côtiers pourraient réduire la profondeur des inondations de 15 % et réduire du même pourcentage les coûts associés aux dommages causés par les inondations, ce qui permettrait d’économiser des millions de dollars (Narayan et coll., 2017; Rezaie et coll., 2020).
En pratique, les services de protection côtière devraient être mesurés par la réduction de la superficie des écosystèmes aménagés ou gérés étant touchés par les inondations. La capacité d’un marais à atténuer les vagues, réduisant de ce fait la puissance et la hauteur des vagues, est un bon indicateur de sa capacité à protéger contre les inondations côtières. Il existe plusieurs études sur la capacité des marais salés à atténuer les vagues et les ondes de tempête sur leur largeur (Möller et coll., 2014; Ngulube, 2021; Rezaie et coll., 2020; Trégarot et coll., 2021). Toutefois, compte tenu des différences importantes observées d’un marais salé à l’autre en ce qui concerne la communauté végétale et la structure de la végétation (section 2.2.3.1 et section 2.2.4.1), la capacité d’atténuation des vagues d’un marais ne peut pas être supposée qu’à partir de sa largeur.
Par conséquent, plutôt que de fournir uniquement des résultats modélisés en fonction de la largeur du marais, les mesures porteront principalement sur les variables qui ont une incidence sur la capacité du marais salé à atténuer les vagues (offre de services) et sur la demande pour ce service. Les variables ayant une incidence sur la capacité d’atténuation des vagues comprennent la forme, la taille, la communauté végétale, la structure des végétaux et la topographie du marais, ainsi que le fait qu’il soit à l’abri du vent ou non (Möller et coll., 2014; Ngulube, 2021; Rezaie et coll., 2020; Trégarot et coll., 2021; Willemsen et coll., 2020). Ces variables peuvent être combinées pour créer un indicateur de la capacité de protection potentielle.
La largeur du marais est un facteur connu de la capacité des marais à fournir des services de protection (Möller et coll., 2014), et il est logique que la longueur de la lisière marine des marais ait également une incidence sur le degré de protection qu’ils peuvent fournir. Les marais qui sont à l’abri du vent ont une plus grande capacité d’atténuation des vagues (Willemsen et coll., 2020); les données sur la vitesse moyenne et la direction du vent pendant la saison des tempêtes seront donc prises en compte dans la mesure de ce service.
Au sein des marais, les tiges des différentes espèces végétales ont une flexibilité unique, ce qui fait en sorte que les degrés de friction et la capacité à ralentir les vagues varient (Barbier et coll., 2013). Les tiges à forte densité permettent d’atténuer les vagues et, par conséquent, les valeurs de l’indice de végétation seront comprises afin de donner une indication de la structure végétale (Thornton et coll., 2019), comme il a été décrit à la section 2.2.4.1. La topographie des marais a également une incidence sur la capacité d’atténuation des vagues, puisque les marais segmentés par de grands chenaux et des marelles permettent aux ondes de tempête de se déplacer plus loin dans les terres (Barbier et coll., 2013). Grâce aux MAN à haute résolution, la proportion des marais présentant ces caractéristiques de faible élévation peut être estimée (section 2.2.1.1); toutefois, il est possible que l’on ne dispose pas de MAN adéquats pour toutes les zones de marais salés.
Le niveau de la demande pour le service de protection sera mesuré en évaluant le type et la superficie des terres, la population, le nombre de bâtiments et la quantité d’infrastructures dans la zone susceptible de subir une onde de tempête d’une hauteur historique maximale. Des facteurs environnementaux comme l’exposition au vent, les propriétés des vagues ainsi que la saisonnalité et la fréquence des tempêtes pourraient être utilisés pour modifier la zone potentiellement touchée.
À l’aide des mesures de la protection potentielle et de la demande de service de protection ci-décrites, on pourrait créer un indicateur pour les services de protection contre les inondations à utiliser dans les comptes. L’indicateur de vulnérabilité côtière présenté en détail dans la plateforme logicielle InVEST (Sharp et coll., 2020) et dans Chaplin-Kramer et coll. (2019) est un exemple de ce type d’indicateur.
Mesures proposées :- Offre : indicateur comprenant la longueur, la largeur, l’exposition au vent, l’indice de végétation, la continuité de la végétation et la topographie du marais.
- Demande : population humaine, infrastructures et type de terres se trouvant à des élévations en deçà ou à la hauteur maximale de l’onde de tempête, en prenant en compte les conditions climatiques et hydrologiques locales
2.3.2.3 Protection contre l’érosion côtière
Les marais salés contribuent également à la stabilisation du littoral, ce qui peut réduire l’érosion côtière rapide observée le long des côtes canadiennes et qui découle des changements climatiques (Conseil national de recherches du Canada, 2007). Les sédiments s’accumulent dans les marais salés en raison de leur dense structure végétale, ce qui fait augmenter la hauteur et la largeur de ces derniers au fil du temps, à moins d’en être empêchés par la présence de structures artificielles (voir la section 2.2.1.1 et la section 2.2.6.1). De plus, les racines des plantes stabilisent le sol en le liant physiquement et en y intégrant de la matière organique qui accroît la cohésivité du sol (Feagin et coll., 2009; Van Eerdt, 1985). Les marais salés diminuent également l’énergie des vagues et, par le fait même, leur capacité d’érosion (Möller et coll., 2014). Il est très difficile d’estimer l’érosion ayant été évitée en l’absence de données locales; par conséquent, on adoptera une méthode semblable à celle servant à mesurer la protection contre les inondations côtières. Un indicateur composé d’un ensemble de variables sera créé en tant que mesure de substitution. Ces variables comprennent les valeurs de la longueur de la lisière marine, de la largeur et des fonctions de l’indice de végétation du marais, lesquelles déterminent l’offre de service. La demande de service (vulnérabilité des terres adjacentes à l’érosion) peut être déterminée en mesurant la population, l’utilisation des terres et la quantité d’infrastructures dans les zones adjacentes aux marais salés, ainsi que le type de substrat et l’exposition de cette zone au vent et aux vagues.
Mesures proposées :- Offre : indicateur de la longueur de la lisière marine, de la largeur, du type de sol et des fonctions de l’indice de végétation
- Demande : population humaine, infrastructures et utilisation des terres se trouvant à une distance précise d’un marais salé
2.3.2.4 Protection contre l’élévation du niveau de la mer
Les marais salés peuvent fournir une protection contre les répercussions de l’élévation du niveau de la mer, comme l’augmentation des inondations et de l’érosion, comme il a été décrit dans les deux sections précédentes. Si, dans les marais, les sédiments peuvent s’accumuler plus rapidement que la vitesse à laquelle le niveau de la mer local s’élève et que l’amplitude des marées augmente, ils protégeront les terres situées derrière eux des répercussions de l’élévation du niveau de la mer et permettront d’éliminer le besoin de mettre en œuvre de coûteux projets d’infrastructure et de déplacer des populations. Même si l’accrétion est plus lente, ils permettront d’étirer le temps avant que les terres adjacentes ne soient inondées en permanence. Comme il a été décrit à la section 2.2.1.1, les MAN permettent d’obtenir une estimation très approximative des taux d’accrétion des marais. Dans les cas où des données sur la turbidité sont disponibles, on obtiendra également une indication de la disponibilité de sédiments susceptibles de s’accumuler dans les marais salés. La demande pour ce service peut être mesurée à partir des estimations locales de l’élévation du niveau de la mer à la fin du siècle, combinées à la population, aux infrastructures et aux types de terres se trouvant à des élévations inférieures à la hauteur de l’élévation prévue du niveau de la mer. Il convient de noter que même si les marais salés peuvent également protéger les populations lorsqu’ils prennent de l’ampleur et s’étalent vers l’intérieur des terres, cela sera considéré comme une variation de l’étendue plutôt qu’un service de protection fourni par le marais.
Mesures proposées :- Offre : taux de variation de l’élévation du marais par rapport à l’élévation du niveau de la mer et à la disponibilité des sédiments dans l’eau
- Demande : population humaine, infrastructures et type de terres dans la zone menacée par l’élévation du niveau de la mer
2.3.3 Régulation intermédiaire
Les services intermédiaires, ou services de soutien, sont ceux qui profitent à un autre écosystème ou à une autre espèce. Ces services intermédiaires contribuent à améliorer l’offre de services finaux et sont essentiels à la préservation de la santé environnementale. Les marais salés fournissent de nombreux services intermédiaires importants, qui appuient à la fois les écosystèmes terrestres et marins.
2.3.3.1 Purification de l’eau
Les marais salés peuvent filtrer le ruissellement des zones agricoles et bâties, et l’empêcher d’atteindre d’autres écosystèmes. Les marais salés filtrent l’excédent d’éléments nutritifs dans le ruissellement (Valiela et coll., 2000) et préviennent l’eutrophisation des zones littorales (Nelson et Zavaleta, 2012), bien que la capacité à fournir ce service puisse varier selon les saisons (Sousa et coll., 2012). La capacité à fournir ce service dépend de facteurs comme la structure végétale (Nelson et Zavaleta, 2012), la durée de l’exposition à des niveaux élevés d’éléments nutritifs (Deegan et coll., 2012) et l’âge du marais (Sousa et coll., 2008).
Les marais salés peuvent également réduire les niveaux de sédiments et la turbidité dans les eaux littorales grâce à leurs fonctions de capture des sédiments (Endresz, 2020). À partir des données sur la variable de condition qu’est la pollution (section 2.2.2.2), l’exposition possible des marais aux polluants sera déterminée et combinée à d’autres renseignements d’ordre physique, y compris les caractéristiques du sol et l’indice de végétation, afin de créer un indicateur de la filtration de l’eau. Les aspects saisonniers, l’âge des marais et le type de végétation seront plus difficiles à évaluer à l’échelle nationale et ne seront pas pris en considération dans le premier compte.
Mesures proposées :- Demande : mesures expliquées à la section 2.2.2.2
- Charge polluante par unité de surface provenant du ruissellement et de sources marines, selon le type de polluant
- Nombre cumulatif d’incidents de pollution au cours d’une période donnée (p. ex. l’année précédente ou les 10 années précédentes), selon le type de polluant, y compris la pollution marine et terrestre
- Mesures de prolifération des algues ou d’eutrophisation dans une unité de distance donnée
- Quantification de l’utilisation des terres avoisinantes lorsqu’il est impossible d’obtenir des mesures directes (section 2.2.6.2)
- Offre : indicateur du type et de la profondeur du sol, et indice de végétation
2.3.3.2 Fourniture d’habitats
Les marais salés procurent un habitat important à de nombreuses espèces, tant terrestres que marines. Pour certaines de ces espèces, le marais salé est un habitat essentiel pendant une partie de leur cycle de vie et ne peut pas être remplacé. En fournissant un habitat à ces animaux, les marais salés soutiennent la biodiversité et la santé environnementale, en plus de soutenir les services finaux tels que la pêche, les loisirs et le sentiment d’appartenance.
De nombreux petits poissons utilisent les chenaux et les marelles des marais comme nourriceries de poissons. Il s’agit notamment du bar d’Amérique (Morone saxatilis), du hareng (Clupea harengus), de l’anguille (Anguilla rostrata), du gaspareau ou gasperot (Alosa pseudoharengus), du choquemort (Fundulus heteroclitus) et, possiblement, du homard juvénile (Homarus americanus) (Able et coll., 2012; Sherren et coll., 2021). En vieillissant, ces espèces deviennent des proies pour les espèces pêchées ou s’ajoutent aux proies disponibles pour la pêche récréative et commerciale.
Bien que les données sur les prises de la pêche récréative ne soient pas disponibles, il est possible d’estimer la contribution à la pêche commerciale à partir de la portion du cycle de vie des espèces qui se passe dans le marais salé. Théoriquement, les données sur la densité des poissons juvéniles dans différents écosystèmes (marais salé, herbiers marins, côte non végétalisée) pourraient être utilisées pour inférer la contribution de différents écosystèmes à la pêche en se fondant sur les travaux de Jänes et coll. (2020). Comme ces données ne sont pas disponibles actuellement, on peut utiliser le concept d’indice de résidence (McCormick et coll., 2021). Une estimation de la contribution des marais salés à la pêche peut être obtenue en attribuant un pourcentage du poids total du stock de poissons recrutés pour la pêche égal au pourcentage de nourriceries de poissons disponibles qui sont des marais salés, en supposant que les taux de mortalité naturelle sont les mêmes pour toutes les nourriceries (Deegan et coll., 2002). Le concept d’indice de résidence pourrait également être élargi au temps passé par les poissons adultes dans différents écosystèmes afin d’obtenir l’incidence d’un écosystème particulier sur l’ensemble du cycle de vie.
Certains papillons et certains oiseaux dépendent également des marais salés. C’est le cas du cuivré des marais salés (Lycaena dospassosi), du bruant de Nelson (Ammospiza nelsoni), du bruant des marais de la plaine côtière (Melospiza georgiana subsp. nigrescens), du chevalier semipalmé (Tringa semipalmata) et du canard noir (Anas rubripes) (Benoit et Askins, 2002; Conservation de la nature Canada, s. d.; Yerkes, s. d.). Cette fourniture d’habitats peut ouvrir la porte à divers services finaux, comme l’approvisionnement par la chasse, les services culturels de loisirs et de bien-être dans la région avoisinante, et la lutte antiparasitaire. Des estimations de la population géographiquement explicites pour chacune de ces espèces constitueraient une mesure idéale de la fourniture d’habitats. Toutefois, puisqu’il n’existe pas de telles estimations pour bon nombre de ces espèces, ce service sera mesuré à l’aide des mêmes mesures que celles de la condition de la biodiversité animale (section 2.2.3.2).
Mesures proposées :- Fourniture de nourriceries : poids des poissons recrutés pour la pêche commerciale proportionnellement à la superficie de la nourricerie qui est un marais salé
- Mesures tirées de la section 2.2.3.2 sur la biodiversité de la faune indigène
- Indice de biodiversité pour les espèces animales qui utilisent les marais salés et ont une aire de répartition connue qui se trouve à une distance précise d’un marais salé, cet indice prenant en compte les renseignements sur l’importance des habitats de marais salés pour ces espèces, leur état de conservation et leur importance (p. ex. espèces clés)
- Nombre d’occurrences individuelles d’espèces clés, indicatrices, rares ou en voie de disparition ou autrement importantes dans une unité spatiale (p. ex. à l’intérieur des limites d’un marais, d’une zone tampon environnante, d’un estuaire)
2.3.3.3 Pollinisation
Par le passé, les marais salés n’étaient pas considérés comme des milieux fournissant des services écosystémiques de pollinisation, puisque de nombreuses espèces de plantes des marais salés sont pollinisées par le vent (Sherren et coll., 2021). Cependant, une nouvelle étude porte à croire que les pollinisateurs utilisent effectivement les marais salés (Roulston, 2021). Des bourdons (Bombus spp.) et des abeilles coupeuses de feuilles (famille : Megachilidae) ont été observés dans des marais salés de la baie de Fundy au moment où les plantes pollinisées par les insectes étaient en fleur. Ces pollinisateurs ont également été observés sur des fleurs de spartine pectinée (Sporobolus michauxianus). La même étude a également révélé que les abeilles coupeuses de feuilles recueillaient des feuilles de spartine pectinée, probablement pour construire leurs nids. Sur la côte Ouest, on a trouvé d’autres preuves de l’utilisation opportuniste des marais salés par les bourdons terricoles (Bombus terricola) (Pojar, 1973). D’autres insectes qui utilisent les marais salés, comme les papillons, les mouches et les moustiques, peuvent également fournir certains services de pollinisation (Peach et Gries, 2016). Ces sources de données laissent penser que les marais salés pourraient soutenir les communautés de pollinisateurs et fournir des services de pollinisation.
La proportion de l’offre de pollinisation sauvage attribuable aux marais salés sera mesurée comme suit : la proportion de la superficie naturelle et semi-naturelle du marais salé se trouvant à une distance de moins de 2 km (distance de vol maximale typique des abeilles) de cultures dépendantes de la pollinisation. Comme les pollinisateurs utilisent plus fréquemment les zones étant situées plus près, une fonction de réduction de la distance sera utilisée. De plus, il pourrait être possible de créer un indicateur du caractère convenable de l’écosystème pour les pollinisateurs, qui pourrait être utilisé pour corriger la proportion estimée de l’offre de pollinisation propre à chaque écosystème. La demande pour la pollinisation sera mesurée au moyen de la superficie des cultures agricoles qui dépendent de la pollinisation (Chaplin-Kramer et coll., 2019) à l’échelle du pays.
Mesures proposées :- Offre : proportion de la superficie de l’écosystème naturel et semi-naturel qui est un marais salé dans une zone tampon de 2 km entourant des cultures dépendantes des pollinisateurs (pondérée à l’aide d’une fonction de réduction de la distance et possiblement corrigée pour prendre en compte le caractère convenable des écosystèmes environnants pour les pollinisateurs)
- Demande : superficie des terres agricoles où se trouvent des cultures dépendantes des pollinisateurs à l’échelle du pays
2.3.4 Services culturels et services non liés à l’utilisation
Les services culturels concernent le fait d’apprécier et de faire l’expérience des écosystèmes directement ou indirectement (Nations Unies et coll., 2021). Ils comprennent des services éducatifs, récréatifs, culturels et non liés à l’utilisation. Le visiteur d’un marais salé peut faire l’expérience de plusieurs services culturels en même temps. Par exemple, il peut consulter un panneau éducatif, profiter d’une activité récréative comme la randonnée pédestre ou la pêche, et ressentir un sentiment de bien-être en passant du temps dans un écosystème sain.
2.3.4.1 Éducation
Les marais salés peuvent fournir des services éducatifs de plusieurs façons. Les panneaux d’interprétation et les visites guidées dans les zones de marais permettent aux visiteurs d’en apprendre davantage sur l’écosystème et les espèces indigènes. Les chercheurs qui étudient les marais salés profitent des services éducatifs, et partagent ces services par l’intermédiaire de publications et d’exposés.
Bien qu’il soit difficile d’estimer la valeur des services éducatifs fournis par les marais salés, il est possible d’y arriver à l’aide d’une combinaison de facteurs. Par exemple, aux fins de comptabilisation, on pourrait utiliser un indicateur fondé sur le nombre de chercheurs qui étudient les aspects des marais salés, le nombre de subventions de recherche accordées par le gouvernement et d’autres organismes, les articles publiés et les thèses d’étudiants ainsi que sur le nombre de programmes éducatifs et de visites guidées axés sur l’écosystème.
Mesure proposée :- Indicateur comprenant le nombre de chercheurs s’intéressant aux marais salés, les subventions de recherche, les articles publiés et les thèses d’étudiants, ainsi que le nombre de visites guidées dans les marais salés entretenus et de programmes éducatifs
2.3.4.2 Loisirs et tourisme
Les marais salés fournissent également des services récréatifs et touristiques lorsqu’on y pratique des activités comme la pêche ou l’observation des oiseaux. La meilleure façon d’estimer ces types d’activités pourrait être d’utiliser les statistiques sur les visites dans les zones où ces dernières font l’objet d’un suivi. Par exemple, le nombre de visites des marais salés dans les parcs nationaux peut être estimé en établissant un lien proportionnel entre le nombre de visites du parc et la superficie des marais salés dans le parc. Toutefois, les services récréatifs et touristiques sont plus difficiles à mesurer pour les marais salés situés à l’extérieur des parcs.
L’une des avenues possibles pour mesurer ces services à l’extérieur des parcs consiste à avoir recours aux données issues de sites Web de science citoyenne comme le GBIF, eBird et iNaturalist, où les membres du public peuvent partager leurs observations d’espèces. Instagram ou d’autres sites de médias sociaux peuvent également être utiles (Chen et coll., 2020). Cependant, l’utilisation de ces types de données pour établir des comptes statistiques présente des difficultés. Ces données renferment des biais inhérents, car ce ne sont pas tous les utilisateurs des marais salés qui partagent leurs renseignements en ligne. Elles doivent donc être utilisées avec prudence, en particulier dans le cas des statistiques servant à comparer différents usages ou différents utilisateurs.
Outre ces possibilités, l’utilisation récréative potentielle peut être mesurée à l’aide d’une fonction de réduction de la distance à partir d’une zone peuplée et au moyen de l’accessibilité (p. ex. la présence de routes), en suivant les modèles utilisés dans deux études récentes (Capriolo et coll., 2020; Mitchell et coll., 2021). De même, les utilisations récréatives potentielles pour les touristes prendront en considération la capacité d’hébergement dans la zone accessible du marais.
Mesures proposées :- Nombre de visiteurs du parc, superficie pondérée pour les marais salés
- Nombre de visites selon les sites de science citoyenne
- Nombre de publications géolocalisées et étiquetées sur les médias sociaux
- Potentiel d’offre de services récréatifs mesuré en se fondant sur l’accessibilité par la route et la distance séparant le marais des zones peuplées
- Potentiel d’offre de services touristiques mesuré en se fondant sur l’accessibilité par la route et la distance séparant le marais des lieux d’hébergement destinés aux touristes
2.3.4.3 Spiritualité et sentiment d’appartenance
Les marais salés peuvent également fournir des services spirituels et de santé mentale aux Canadiens grâce à leur existence et à leur utilisation. Par exemple, le fait de savoir que le littoral près duquel on habite est sain et procure une protection contre les dangers est considéré comme un service bénéfique. De plus, il a été démontré que les balades en milieu naturel (p. ex. bain de forêt) réduisent le stress (Hanson et coll., 2017). À ces égards, des marais sains sont susceptibles d’améliorer l’offre de services. Ainsi, un indicateur d’accessibilité (section 2.3.4.2) combiné à un indicateur de la condition générale du marais fournira une estimation de ce service.
Les marais salés procurent également des services spirituels et des services liés au sentiment d’appartenance propres aux peuples autochtones. L’écosystème des marais salés est important pour les nations autochtones, y compris les Mi’kmaq du Canada atlantique (Sherren et coll., 2021) et plusieurs nations de la côte Ouest (Turner et coll., 2013), comme il est expliqué à la section 2.3.1. La valeur culturelle des marais salés pour les nations autochtones ne peut être mesurée sans leur participation.
De par leur nature, ces services liés au bien-être sont extrêmement difficiles à mesurer, puisqu’ils sont intangibles et chevauchent souvent d’autres types de services (p. ex. des services d’approvisionnement comme la récolte d’aliments). Une complication supplémentaire est que la valeur d’un écosystème varie en fonction des personnes et des caractéristiques de la population. Ainsi, l’âge et l’origine ethnique, ainsi que d’autres marqueurs sociaux, peuvent jouer un rôle dans le niveau de service reçu d’un écosystème donné. Pour prendre cela en compte, dans la mesure du possible, la composante de la demande de la population pour le service sera désagrégée. Le potentiel d’offre des services spirituels et de services liés au sentiment d’appartenance sera mesuré de la même façon que celui de l’offre des services récréatifs (section 2.3.4.2), en se fondant sur la proximité des routes d’accès et des zones peuplées.
Mesures proposées :- Offre : indicateur de la condition combiné à d’autres mesures après consultation des groupes d’utilisateurs clés
- Potentiel de l’offre des services culturels évalué en fonction de l’accès par la route et de la distance séparant le marais des zones peuplées, ainsi que de la composition de la population locale
2.3.4.4 Services non liés à l’utilisation
Les services non liés à l’utilisation sont fournis par un écosystème sans égard au fait qu’ils soient utilisés ou non et qu’ils soient destinés ou non à être utilisés par les personnes (Nations Unies et coll., 2021). Deux mesures des services non liés à l’utilisation sont le statut de protection ou de conservation des marais salés et le statut de protection des espèces qui utilisent les marais salés (Vind, 2018). En accordant un statut protégé aux marais ou aux espèces qui y sont associées, on attribue une valeur intrinsèque à la pérennité de son existence et de sa santé au profit des générations futures.
Les cartes des aires protégées et conservées en combinaison avec l’étendue des marais salés (Environnement et Changement climatique Canada, 2022) permettent de déterminer la superficie des marais qui est conservée. Cependant, cette mesure présente certains problèmes. Premièrement, le pourcentage obtenu sera probablement trop élevé, car les marais salés protégés sont plus susceptibles d’être cartographiés et donc inclus dans les comptes d’étendue. Deuxièmement, il arrive que l’on crée des aires protégées de façon opportuniste dans des régions où l’utilisation par l’homme est rare ou inexistante, dans le but de respecter les promesses liées à l’atteinte des cibles en matière d’aires protégées. Ces aires ne sauraient être considérées comme des endroits offrant des services culturels, puisqu’elles ne sont pas expressément protégées en raison de leur valeur intrinsèque particulière.
Pour mesurer l’utilisation des marais salés par des espèces protégées, les données sur les aires de répartition des espèces protégées pour lesquelles les marais salés sont un habitat connu (voir la section 2.2.3.2 et la section 2.3.3.2) seront couplées aux données sur l’étendue des marais salés de sorte à créer un registre des aires de répartition des espèces protégées qui chevauchent des marais salés. La liste des espèces protégées en vertu de la Loi sur les espèces en péril sera utilisée pour déterminer le statut de protection.
Mesures proposées :- Pourcentage de la superficie protégée ou conservée des marais salés
- Nombre d’espèces protégées utilisant un habitat de marais salé
2.3.5 Services perçus comme préjudiciables
Enfin, une analyse sur les services écosystémiques ne serait pas complète sans mentionner les services que certains pourraient ne pas considérer comme avantageux. Ces quelques desservices écosystémiques ont tendance à être perçus de façon négative à l’échelle locale uniquement, quoiqu’ils soutiennent les services régionaux et mondiaux décrits plus haut.
D’abord, comme de vastes zones de marais salés sont régulièrement inondées par les marées et contiennent des matières végétales en décomposition, les niveaux d’oxygène dans le sol sont faibles, ce qui peut entraîner une accumulation de bactéries, particulièrement dans les marais caractérisés par de bas niveaux de renouvellement de l’eau par les marées, où l’on peut remarquer une odeur de soufre semblable à celle des œufs pourris (Friess et coll., 2021). Cette odeur peut être désagréable pour les visiteurs ou les résidents locaux. Toutefois, on ne fait pas état de cette situation fréquemment, et ce même processus permet aux marais salés de stocker du carbone (section 2.3.2.1), ce qui, en fin de compte, réduit les concentrations des gaz à effet de serre dans l’atmosphère.
Ensuite, de petites poches d’eau dans les marais salés peuvent fournir un habitat de reproduction aux moustiques, ce qui pourrait être une nuisance pour la population locale (Friess et coll., 2021). Les moustiques sont toutefois un élément important de la chaîne alimentaire, car ils sont une source de nourriture pour les oiseaux, les poissons et les autres insectes. Les moustiques peuvent également fournir certains services de pollinisation, selon la communauté de plantes florifères locale (Peach et Gries, 2016). Les méthodes de contrôle des moustiques, quand elles sont appliquées aux marais (modification de l’hydrologie ou épandage de pesticides), pourraient avoir des répercussions sur l’ensemble de la communauté des insectes du marais et, par conséquent, sur un certain nombre de services écosystémiques (Rochlin et coll., 2011).
Étant donné que les desservices écosystémiques ne sont pas pris en considération dans les comptes du SCEE-CE, on ne propose pas de mesures pour ces deux services préjudiciables.
| Service | Facteurs déterminant l’offre | Facteurs déterminant l’utilisation | Mesures ou mesures de substitution pour la quantification des services | Avantages | Principaux utilisateurs et bénéficiaires | |
|---|---|---|---|---|---|---|
| Écologiques | Sociétaux | |||||
| Approvisionnement | ||||||
| Récolte d’aliments dans la nature : plantes | Condition de l’écosystème; climat; hydrologie | Gestion de l’écosystème; pratiques de récolte | Demande locale | Biomasse récoltée; données sur les ventes, comportement lors de la recherche de nourriture | Produits récoltés | Population locale; restaurants et autres entreprises |
| Récolte d’aliments dans la nature : poissons | Structure de la marelle; hydrologie; biomasse locale des populations de poissons; état chimique de l’eau | Gestion de l'écosystème et des stocks; pratiques de récolte | Demande locale | Biomasse récoltée; comportement lors de la recherche de nourriture | Produits récoltés | Pêcheurs récréatifs; population locale et restaurants |
| Récolte à des fins médicinales, culturelles et autres | Condition de l’écosystème; climat; hydrologie | Gestion de l’écosystème; pratiques de récolte | Demande locale | Biomasse récoltée; comportement lors de la recherche de nourriture | Produits récoltés | Population locale |
| Régulation | ||||||
| Régulation du climat | État structurel du marais; offre de sédiments et profondeur de ces derniers; structure de la végétation; concentrations de carbone atmosphérique | Gestion de l’écosystème; émissions de gaz à effet de serre | Vulnérabilité face aux changements climatiques | Estimation de la séquestration et du stockage de carbone selon la zone | Réduction des gaz à effet de serre atmosphériques, ce qui atténue les changements climatiques et réduit leurs effets néfastes | Population mondiale, entreprises et gouvernements |
| Protection contre les inondations côtières | Étendue et structure de la végétation; structure des marais; conditions locales des marées et des tempêtes | Gestion de l’écosystème | Zones à valeur économique étant à risque d’inondation; étendue des autres barrières contre les inondations (p. ex. les digues) | Indicateur reposant sur la largeur et la longueur du marais, la vitesse du vent, l’indice de végétation et la topographie | Diminution des dommages et des coûts associés aux ondes de tempête | Population et entreprises locales; infrastructures |
| Protection contre l’érosion côtière | État structurel du marais; profondeur des sédiments; étendue et structure de la végétation | Gestion de l’écosystème | Zones à valeur économique; infrastructures; bâtiments et population à proximité des côtes | Indicateur reposant sur la longueur et la largeur du marais, le type de sol et l’indice de végétation | Réduction du risque d’inondation et de retrait des biens; infrastructures et agriculture dans les zones côtières | Population et entreprises locales; infrastructures |
| Protection contre l’élévation du niveau de la mer | Taux de variation de la surface du marais (accrétion, érosion), disponibilité des sédiments | Gestion de l’écosystème | Zones à valeur économique; infrastructures; bâtiments et population dans une zone dont l’élévation est inférieure à l'élévation prévue du niveau de la mer | Taux de variation de la surface du marais et disponibilité des sédiments | Diminution du risque d’inondations futures et du besoin en infrastructures de protection coûteuses; réduction des dommages causés par l’élévation du niveau de la mer | Population et entreprises locales; infrastructures |
| Régulation intermédiaire | ||||||
| Purification de l’eau | Structure de la végétation; profondeur du sol; condition du sol | Gestion de l’écosystème; emplacement, types et quantités de polluants rejetés | Emplacement, type et volume des émissions polluantes | Indicateur reposant sur l'indice de végétation, le type de sol et sa profondeur | Amélioration de la qualité de l'eau dans l'océan et les terres agricoles environnants | Autres écosystèmes et les bénéficiaires de leur offre de services |
| Fourniture d’habitats : nourriceries de poissons | Condition de l’écosystème; structure des marelles; hydrologie; biodiversité; présence d’espèces envahissantes | Gestion et protection de l’écosystème et des stocks | Demande en biomasse d'espèces qui dépendent des nourriceries de poissons | Biomasse de recrutement dans la pêche ajustée selon le pourcentage de la superficie des nourriceries de poissons qui sont des marais salés | Offre continue de services écosystémiques d’approvisionnement à l’océan | Pêcheurs individuels et de l'industrie; consommateurs domestiques indirects |
| Fourniture d’habitat : habitat terrestre | Condition de l’écosystème; conditions environnementales locales; présence d’espèces envahissantes | Gestion et protection de l’écosystème | Demande d’autres écosystèmes en services de la lutte antiparasitaire; biomasse; exigences fonctionnelles dépendantes de la biodiversité | Compte des occurrences individuelles d’espèces dans la zone; indice de biodiversité des espèces clés utilisant les marais | Offre continue de services de lutte antiparasitaire; soutien aux autres services écosystémiques; valeur intrinsèque de l’écosystème | Zones agricoles et bâties locales (contrôle des insectes par les oiseaux); autres écosystèmes |
| Pollinisation | Condition de l’écosystème; abondance des pollinisateurs; types de plantes | Gestion et protection de l’écosystème | Emplacement des cultures profitant de la pollinisation sauvage | Superficie des cultures pollinisées par des pollinisateurs sauvages utilisant les marais salés | Réduction des besoins pour d’autres formes de pollinisation, y compris les services de pollinisation rémunérés | Zones agricoles locales (commerciales, de subsistance et domestiques); consommateurs domestiques indirects |
| Services culturels et services non liés à l'utilisation | ||||||
| Éducation | Étendue; condition; état structurel; caractéristiques des paysages terrestres et marins | Accès au site; gestion de l’écosystème | Politique en matière d’éducation; financement de la recherche | Indicateur comprenant le nombre de chercheurs s’intéressant aux marais salés, les subventions de recherche, les articles publiés et les thèses d’étudiants, ainsi que le compte des visites dans les marais salés entretenus et de programmes éducatifs | Développement cognitif, avancement des connaissances et de la compréhension | Organismes d’enseignement et de recherche; population générale, en particulier les étudiants; industrie |
| Loisirs et tourisme | Étendue; condition; caractéristiques des paysages terrestres et marins | Accès au site; gestion de l’écosystème | Accessibilité | Nombre de visiteurs; potentiel récréatif fondé sur l’accessibilité; comptes tirés de la science citoyenne et des publications sur les médias sociaux | Santé physique et mentale des utilisateurs | Population locale; organismes de loisirs; touristes et entreprises touristiques |
| Spiritualité et sentiment d’appartenance | Étendue; condition | Gestion de l’écosystème; pratiques culturelles | Chiffre de population locale; accessibilité | Indicateur de la condition, offre potentielle selon l’accessibilité | Sentiment de bien-être; pérennité des pratiques culturelles; santé spirituelle des utilisateurs | Population locale |
| Services non liés à l'utilisation | Étendue; condition; services | Gestion de l’écosystème et du site; lien de la société avec les marais salés | Connaissance et reconnaissance de l’écosystème et de ses services | Pourcentage de la superficie protégée ou conservée des marais salés; comptes des espèces protégées au Canada qui utilisent les marais salés | Sentiment de bien-être | Population mondiale |
3. Conclusion et prochaines étapes
Ce document présente un cadre pour l’établissement des comptes écosystémiques et propose des mesures qui permettront de dresser le tableau complet de l’étendue, de la condition et des services écosystémiques des marais salés au Canada. À partir de ce cadre, les comptes seront élaborés graduellement, en se penchant d’abord sur les variables priorisées en fonction de la disponibilité, de la complexité et de l’importance des données. Une fois ces comptes élaborés, ils pourront être régulièrement mis à jour, à mesure que les données, les connaissances et les techniques de modélisation s’amélioreront.
Un marais salé est un écosystème côtier dynamique et important qui fournit plusieurs services écosystémiques essentiels. Ce n’est que récemment que la société a commencé à mieux comprendre cet écosystème négligé par le passé. Pour cette raison, les connaissances sur les marais salés présentent de nombreuses lacunes. Le marais salé a été sélectionné parmi les premiers écosystèmes d’intérêt du Recensement de l’environnement afin de mettre en évidence les principales lacunes en matière de données et alimenter les discussions sur la façon de les combler pour améliorer notre compréhension de cet écosystème.
Référence proposée
Rabinowitz, T.R.M., et J. Andrews. (2022). Évaluer la valeur de l’écosystème des marais salés : Élaboration de comptes écosystémiques, Série de documents analytiques et techniques sur les comptes et la statistique de l’environnement, produit no 16-001-M au catalogue de Statistique Canada.
Références
ABLE, K. W., VIVIAN, D. N., PETRUZZELLI, G. et HAGAN, S. M. (2012). Connectivity among salt marsh subhabitats: Residency and movements of the Mummichog (Fundulus heteroclitus). Estuaries and Coasts, 35, p. 743 à 753.
AGRICULTURE ET AGROALIMENTAIRE CANADA. (2018, 25 janvier). Séries chronologiques d'utilisation des terres semi-décennales d'AAC. Repéré le 31 janvier 2022 à Gouvernement ouvert Canada: https://open.canada.ca/data/fr/dataset/fa84a70f-03ad-4946-b0f8-a3b481dd5248
ÁLVAREZ-ROGEL, J., JIMÉNEZ-CÁRCELES, F. J., ROCA, M. J. et ORTIZ, R. (2007). Changed in soils and vegetation in a Mediterranean coastal salt marsh impacted by human activities. Estuarine Coastal and Shelf Science, 73, p. 510 à 526.
AMAN, J. et WILSON GRIMES, K. (2016). Measuring impacts of invasive European green crabs on Maine salt marshes: A novel approach. Wells National Estuarine Research Reserve. Repéré le 6 janvier 2022 à https://www.wellsreserve.org/writable/files/archive/science-pubs/mohf_green-crab-report-2016.pdf
ARGOW, B. A., HUGHES, Z. J. et FITZGERALD, D. M. (2011). Ice raft formation, sediment load, and theoretical potential for ice-rafted sediment influx on northern coastal wetlands. Continental Shelf Research, 31(12), p. 1294 à 1305.
BALTZER, J. L., HEWLIN, H. L., REEKIE, E. G. et TAYLOR, P. D. (2002). The impact of flower harvesting on seedling recruitment in sea lavender (Limonium carolinianum, Plumbaginaceae). Rhodora, 104(919), p. 280 à 295.
BARBIER, E. B., GEORGIOU, I. Y., ENCHELMEYER, B. et REED, D. J. (2013, mars). The value of wetlands in protecting Southeast Louisiana from hurricane storm surges. PLoS One, 8(3).
BENOIT, L. K. et ASKINS, R. A. (2002). Relationship between habitat area and the distribution of tidal marsh birds. The Wilson Bulletin, 114(3), p. 314 à 323.
BERTNESS, M. D., EWANCHUK, P. J. et SILLIMAN, B. R. (2002). Anthropogenic modification of New England salt marsh landscapes. PNAS, 99(3), p. 1395 à 1398.
BERTNESS, M. D., SILLIMAN, B. R. et JEFFERIES, R. (2004). Salt marshes under siege. American Scientist, 92, p. 54 à 61. Sigma Xi.
BOWRON, T. M., NEATT, N., VAN PROOSDIJ, D. et LUNDHOLM, J. (2012). Salt marsh tidal restoration in Canada's Maritime provinces. Dans C. T. Roman et D. M. Burdick (dir.), Tidal marsh restoration (p. 191 à 209). Washington, DC: Island Press.
BOZEK, C. M. et BURDICK, D. M. (2005). Impacts of seawalls on saltmarsh plant communities the Great Bay Estuary, New Hampshire USA. Wetlands Ecology and Management, 13, p. 553 à 568.
BROOME, S. W., SENECA, E. D. et WOODHOUSE JR., W. W. (1983). The effects of source, rate and placement of nitrogen and phosphorus fertilizers on growth of Spartina alterniflora transplants in North Carolina. Estuaries, 6(3), p. 212 à 226.
BUTZECK, C., ESCHENBACH, A., GRÖNGRÖFT, A., HANSEN, K., NOLTE, S. et JENSEN, K. (2015). Sediment deposition and accretion rates in tidal marshes are highly variable along estuarine salinity and flooding gradients. Estuaries and Coasts, 38, p. 434 à 450. https://doi.org/10.1007/s12237-014-9848-8
CAHOON, D. R., MCKEE, K. L. et MORRIS, J. T. (2020). How plants influence resilience of salt marsh and mangrove wetlands to sea-level rise. Estuaries and Coasts, 44(4), p. 883 à 898. https://doi.org/10.1007/s12237-020-00834-w
CAPRIOLO, A., BOSCHETTO, R. G., MASCOLO, R. A., BALBI, S. et VILLA, F. (2020). Biophysical and economic assessment of four ecosystem services for natural capital accounting in Italy. Ecosystem Services, 46, 101207.
CHAPLIN-KRAMER, R., SHARP, R. P., WEIL, C., BENNETT, E. M., PACUAL, U., ARKEMA, K. K., BRAUMAN, K. A., BRYANT B. P., GUERRY, A. D., HADDAD, N. M., HAMANN, M., HAMEL, P., JOHNSTON, J. A., MANDLE, L., PEREIRA, H. M., POLASKY, S., RUCKELSHAUS, M., SHAW, M. R., SILVER, J. M., . . . DAILY, G. C. (2019). Global modeling of nature's contributions to people. Science, 366(6462). https://doi.org/10.1126/science.aaw3372
CHARLES, H. et DUKES, J. S. (2009). Effects of warming and altered precipitation on plant and nutrient dynamics of a New England salt marsh. Ecological Applications, 19(7), p. 1758 à 1773.
CHASTAIN, S. (2017). Carbon stocks and accumulation rates in salt marshes of the Pacific coast of Canada [mémoire de maîtrise, Simon Fraser University]. Repéré à http://rem-main.rem.sfu.ca/theses/ChastainStephen_2017_MRM683.pdf
CHEN, Y., CAESEMAECKER, C., RAHMAN, H. T. et SHERREN, K. (2020). Comparing cultural ecosystem service delivery in dykelands and marshes using Instagram: A case of the Cornwallis (Jijuktu'kwejk) River, Nova Scotia, Canada. Ocean and Coastal Management, 193, 105254.
CHMURA, G. L. et HUNG, G. A. (2004). Controls on salt marsh accretion: A test in salt marshes of Eastern Canada. Estuaries, 27(1), p. 70 à 81.
CLAPSON, D. (2014, 11 août). What the hell is sea asparagus? Repéré le 13 septembre 2021 à https://eatnorth.com/dan-clapson/what-hell-sea-asparagus
COHEN, R. (2018, 12 mars). Edible wild plants native to the Northeast U.S. and Eastern Canada. Repéré le 16 décembre 2021 à https://massland.org/sites/default/files/files/Edible%20Wild%20Plants%20Native%20to%20the%20Northeast%20and%20eastern%20Canada%20-%20March%202018%20compilation.pdf
COLE, M. L., KROEGER, K. D., MCCLELLAND, J. W. et VALIELA, I. (2006). Effects of watershed land use on nitrogen concentrations and δ15 nitrogen in groundwater. Biogeochemistry, 77, p. 199 à 215.
COLOMBANO, D. D., LITVIN, S. Y., ZIEGLER, S. L., ALFORD, S. B., BAKER, R., BARBEAU, M. A., CEBRIÁN, J., CONNOLLY, R. M., CURRIN, C. A., DEEGAN, L. A., LESSER, J. S., MARTIN, C. W., MCDONALD, A. E., MCLUCKIE, C., MORRISON, B. H., PAHL, J. W., RISSE, L. M., SMITH, J. A. M., STAVER, L. W., . . . WALTHAM, N. J. (2021). Climate change implications for tidal marshes and food web linkages to estuarine and coastal nekton. Estuaries and Coasts, 44, p. 1637 à 1648. https://doi.org/10.1007/s12237-020-00891-1
CONNOR, R. F., CHMURA, G. L. et BEECHER, C. B. (2001). Carbon accumulation in Bay of Fundy salt marshes: Implications for restoration of reclaimed marshes. Global Biogeochemical Cycles, 14(4), p. 943 à 954.
CONSERVATION OF ARCTIC FLORA AND FAUNA. (2013). Arctic biodiversity assessment: Report for policy makers. Akureyi, Iceland. Repéré le 24 novembre 2021 à http://www.arcticbiodiversity.is/index.php/the-report/report-for-policy-makers/key-findings
COOPER, A. (1982). The effects of salinity and waterlogging on the growth and cation uptake of salt marsh plants. The New Phytologist, 90, p. 263 à 275.
CRAFT, C., CLOUGH, J., EHMAN, J., JOYE, S., PARK, R., PENNINGS, S., GUO, H. et MACHMULLER, M. (2009). Forecasting the effects of accelerated sea-level rise on tidal marsh ecosystem services. Frontiers in Ecology and the Environment, 8(2), p. 73 à 78. https://doi.org/10.1890/070219
CRAIN, C. M., SILLIMAN, B. R., BERTNESS, S. L. et BERTNESS, M. D. (2004). Physical and biotic drivers of plant distribution across estuarine salinity gradients. Ecology, 85(9), p. 539 à 2549.
CURRIN, C. A. (2019). Living shorelines for coastal resilience. Dans G. M. Perillo, E. Wolanski, D. R. Cahoon et C. S. Hopkinson (dir.), Coastal wetlands: An integrated ecosystem approach (p. 1023 à 1053). Elsevier B.V.
DA LIO, C., TEATINI, P., STOZZI, T. et TOSI, L. (2018). Understanding land subsidence in salt marshes of the Venice Lagoon from SAR Interferometry and ground-based investigations. Remote Sensing of Environment, 205, p. 56 à 70.
DAWE, N. K., BOYD, W. S., MARTIN, T., ANDERSON, S. et WRIGHT, M. (2015). Significant marsh primary production is being lost from the Campbell River estuary: Another case of too many resident Canada Geese (Branta canadensis)? British Columbia Birds, 25, p. 2 à 12.
DEEGAN, L. A., HUGHES, J. E. et ROUNTREE, R. A. (2002). Salt marsh ecosystem support of marine transient species. Dans M. K. Weinstein (dir.), Concepts and controversies in tidal marsh ecology (p. 333 à 365). Dordrecht: Springer.
DEEGAN, L. A., JOHNSON, D. S., WARREN, R. S., PETERSON, B. J., FLEEGER, J. W., FAGHERAZZI, S. et WOOLLHEIM, W. M. (2012). Coastal eutrophication as a driver of salt marsh loss. Nature, 490(7420), p. 388 à 392.
DELAUNE, R. D., REDDY, C. N. et PATRICK JR., W. H. (1981). Accumulation of plant nutrients and heavy metals through sedimentation processes and accretion in a Louisiana salt marsh. Estuaries, 4(4), p. 328 à 334.
DIONNE, J. C. (1969). Tidal flat erosion by ice at La Pocatière, St. Lawrence Estuary. Journal of Sedimentary Petrology, 39, p. 1174 à 1181.
DIONNE, J. C. (1993). Sediment load of shore ice and ice rafting potential, upper St. Lawrence Estuary, Québec, Canada. Journal of Coastal Research, 9, p. 628 à 646.
DOODY, J.P., (2004). Coastal squeeze – an historical perspective. Journal of Coastal Conservation 10, p. 129 à 138.
DUGAN, J. E., AIROLDI, L., CHAPMAN, M. G., WALKER, S. J. et SCHLACHER, T. (2011). Estuarine and coastal structures: Environmental effects, a focus on shore and nearshore structure. Dans E. Wolanski et D. McLusky (dir.), Treatise on estuarine and coastal science (p. 17 à 41). Elsevier.
EASTWOOD, J. A., YATES, M. G., THOMSOM, A. G. et FULLER, R. M. (1997). The reliability of vegetation indices for monitoring saltmarsh vegetation cover. International Journal of Remote Sensing, 18(18), p. 3901 à 3907.
EDDY, T. D., LAM, V. W., REYGONDEAU, G., CISNEROS-MONTEMAYOR, A. M., GREER, K., PALOMARES, M. L., . . . CHUNG, W. W. (2021). Global decline in capacity of coral reefs to provide ecosystem services. One Earth, 4, p. 1278 à 1285.
ENDRESZ, K. (2020). Understanding the ecological linkages between salt marsh ecosystems and nearshore fisheries [mémoire de maîtrise, Dalhousie University]. DalSpace Institutional Repository.
ENVIRONNEMENT ET CHANGEMENT CLIMATIQUE CANADA. (2020). Zones humides importantes à l’échelle internationale : Convention de Ramsar. Repéré le 26 janvier 2022 à https://www.canada.ca/fr/environnement-changement-climatique/organisation/affaires-internationales/partenariats-organisations/zones-humides-importantes-convention-ramsar.html
ENVIRONNEMENT ET CHANGEMENT CLIMATIQUE CANADA. (2021). Réserve nationale de faune du marais John Lusby. Repéré le 3 février 2022 à https://www.canada.ca/fr/environnement-changement-climatique/services/reserves-nationales-faune/existantes/marais-john-lusby.html
ENVIRONNEMENT ET CHANGEMENT CLIMATIQUE CANADA. (2022). Base de données canadienne sur les aires protégés et de conservation. Repéré le 24 mai 2022 à https://www.canada.ca/fr/environnement-changement-climatique/services/reserves-nationales-faune/base-donnees-aires-protegees-conservation.html
EWANCHUK, P. J. et BERTNESS, M. D. (2003). Recovery of a northern New England salt marsh plant community from winter icing. Oecologia, 136(4), p. 616 à 626.
FEAGIN, R. A., LOZADA-BERNARD, S. M., RAVENS, T. M., MÖLLER, I., YEAGER, K. M. et BAIRD, A. H. (2009). Does vegetation prevent wave erosion of salt marsh edges? PNAS, 106(25), p. 10109 à 10113. https://doi.org/10.1073/pnas.0901297106
FITZGERALD, D. M. et HUGHES, Z. (2019). Marsh processes and their responses to climate change and sea-level rise. Annual Reviews of Earth and Planetary Sciences, 47, p. 481 à 517. https://doi.org/10.1146/annurev-earth-082517-010255
FRENCH, J. (2019). Tidal salt marshes: Sedimentology and geomorphology. Dans G. M. Perillo, E. Wolanski, D. R. Cahoon et C. S. Hopkinson (dir.), Coastal wetlands: An integrated ecosystem approach (2e éd., p. 479 à 517). Elsevier B.V.
FRIESS, D. A., YANDO, E. S., ALEMU, J. B., WONG, L.-W., SOTO, S. D. et BHATIA, N. (2021). Ecosystem services and disservices of mangrove forests and salt marshes. Dans S. Hawkins, A. Allcock, A. Bates, A. Evans, L. Firth, C. McQuaid, . . . P. Todd (dir.), Oceanography and marine biology: An annual review (vol. 58, p. 107 à 140). CRC Press, Taylor & Francis Group.
GABET, E. J. (1998). Lateral migration and bank erosion in a saltmarsh tidal channel in San Francisco. Estuaries, 21(4 Part B), p. 745 à 753.
GAILIS, M., KOHFELD, K. E., PELLAT, M. G. et CARLSON, D. (2021). Quantifying blue carbon for the largest salt marsh in southern British Columbia: Implications for regional coastal management. Coastal Engineering Journal, 63(3), p. 275 à 309. https://doi.org/10.1080/21664250.2021.1894815
GALLARDO, B., CLAVERO, M., SÀNCHEZ, M. I. et MONTSERRAT, V. (2015). Global ecological impacts of invasive species in aquatic ecosystems. Global Change Biology, 22(1), p. 151 à 163. https://doi.org/10.1111/gcb.13004
GEDAN, K. B., SILLIMAN, B. R. et BERTNESS, M. D. (2009). Centuries of human-driven change in salt marsh ecosystems. Annual Review of Marine Science, 1, p. 117 à 141. https://doi.org/10.1146/annurev.marine.010908.163930
GERWING, T. G., THOMSON, H. M., BROUARD-JOHN, E. K., KUSHNERYK, K., DAVIES, M. M., LAWN, P. et NELSON, K. R. (2021). Observed dispersal of invasive yellow flag iris (Iris pseudacorus) through a saline marine environment and growth in a noval substrate, shell hash. Wetlands, 41(1). https://doi.org/10.1007/s13157-021-01421-w
GHOSH, S., MISHRA, D. R. et GITELSON, A. A. (2016). Long-term monitoring of biophysical characteristics of tidal wetlands in the northern Gulf of Mexico – A methodological approach using MODIS. Remote Sensing of Environment, 173, p. 39 à 58.
GITELSON, A. A. (2004). Wide dynamic range vegetation index for remote quantification of biophysical characteristics of vegetation. Journal of Plant Physiology, 161, p. 165 à 173.
GLEASON, M. L., ELMER, D. A., PIEN, N. C. et FISHER, J. S. (1979). Effects of stem density upon sediment retention by salt marsh cord grass, Spartina alterniflora loisel. Estuaries, 2(4), p. 271 à 273.
GRENFELL, S. E., FORTUNE, F., MAMPHOKA, M. F. et SANDERSON, N. (2019). Coastal wetland resilience to climate change: modelling ecosystem response to rising sea level and salinity in a variable climate. Anthropocene Coasts, 2, p. 1 à 20. https://doi.org/10.1139/anc-2018-0004
GROUT, J. A., LEVINGS, C. D. et RICHARDSON, J. S. (1997). Decomposition rates of purple loosestrife (Lythrum salicaria) and lyngbyei's sedge (Carex lyngbyei) in the Fraser River Estuary. Estuaries, 20(1), p. 96 à 102.
GULEV, S. K., THORNE, P. W., AHN, J., DENTENER, F. J., DOMINGUES, C. M., GERLAND, S., GONG, D., KAUFFMAN, D. S., NNAMCHI, H. C., QUAAS, J., RIVERA, J. A., SMITH, S. L., TREWIN, B. et VOSE, R. S. (2021). Changing state of the climate system. Dans V. Masson-Delmotte, P. Zhai, A. Pirani, S. Connors, C. Péan, S. Berger, . . . B. Zhou (dir.), Climate change 2021: The physical science basis. Contribution of working group I to the sixth assessment report of the Intergovernmental Panel on Climate Change. Cambridge University Press.
HANSON, M. M., JONES, R. et TOCCHINI, K. (2017). Shinrin-Yoku (forest bathing) and nature therapy: A state-of-the-art review. International Journal of Environmental Research and Public Health, 14(8), p. 851. https://doi.org/10.3390/ijerph14080851
HARDISKY, M. A., DAIBER, F. C., ROMAN, C. T. et KLEMA, V. (1984). Remote sensing of biomass and annual net aerial primary productivity of a salt marsh. Remote Sensing of Environment, 16, p. 91 à 106.
HARNEY, J. (2008). Modeling habitat suitability for the invasive salt marsh cordgrass Spartina using ShoreZone coastal habitat mapping data in Southeast Alaska, British Columbia, and Washington State. Sidney, C.-B. : Coastal & Ocean Resources Inc.
HEERY, E. C., BISHOP, M. J., CRITCHLEY, L. P., BUGNOT, A. B., AIROLDI, L., MAYER-PINTO, M., SHEEHAN, E. V., COLEMAN, R. A., LOKE, L. H. L., JOHNSTON, E. L., KOMYAKOVA, V., MORRIS, R. L., STRAIN, E. M. A., NAYLOR, L. A. et DAFFORN, K. A. (2017). Identifying the consequences of ocean sprawl for sedimentary habitats. Journal of Experimental Marine Biology and Ecology, 492, p. 31 à 48.
HLADIK, C., SCHALLES, J. et ALBER, M. (2013). Salt marsh elevation and habitat mapping using hyperspectral and LIDAR data. Remote Sensing of Environment, 139, p. 318 à 330.
HOUTTUIJN BLOEMENDAAL, L. J., FITZGERALD, D. M., HUGHES, Z. J., NOVAK, A. B. et PHIPPEN, P. (2021). What controls marsh edge erosion? Geomorphology, 386, p. 107745. https://doi.org/10.1016/j.geomorph.2021.107745
HUGHES, Z. J., FITZGERALD, D. M., WILSON, C. A., PENNINGS, S. C., WIĘSKI, K. et MAHADEVAN, A. (2009). Rapid headward erosion of marsh creeks in response to relative sea level rise. Geophysical Research Letters, 36, L03602. https://doi.org/10.1029/2008GL036000
INVASIVE SPECIES CENTRE. (s. d.). Purple Loosestrife (Lythrum salicaria). Repéré le 24 novembre 2021 à https://www.invasivespeciescentre.ca/invasive-species/meet-the-species/invasive-plants/purple-loosestrife/
JÄNES, H., MACREADIE, P. I., ZU ERMGASSEN, P. S., GAIR, J. R., TREBY, S., REEVES, S., NICHOLSON, E., IERODIANCONOU, D. et CARNELL, P. (2020). Quantifying fisheries enhancement from coastal vegetated ecosystems. Ecosystem Services, 43, p. 101105.
JEFFERIES, R. L., JANO, A. P. et ABRAHAM, K. F. (2006). A biotic agent promotes large-scale catastrophic change in the coastal marshes of Hudson Bay. Journal of Ecology, 94, p. 234 à 242.
JENSEN, D., CAVANAUGH, K. C., SIMARD, M., OKIN, G. S., CASTEÑADA-MOYA, E., MCCALL, A. et TWILLEY, R. R. (2019). Integrating imaging spectrometer and synthetic aperture radar data for estimating wetlands vegetation aboveground biomass in coastal Louisiana. Remote Sensing, 11(21), p. 2533. https://doi.org/10.3390/rs11212533
KEARNEY, M. S., STUTZER, D., TURPIE, K. et COURT, S. J. (2009). The effects of tidal inundation on the reflectance characteristics of coastal marsh vegetation. Journal of Coastal Research, 25(6), p. 1177 à 1186.
KEARNEY, W. S. et FAGHERAZZI, S. (2016). Salt marsh vegetation promotes efficient tidal channel networks. Nature Communications, 7, p. 12287. https://doi.org/10.1038/ncomms12287
KEITH, D. A., FERRER-PARIS, J. R., NICHOLSON, E. et KINGSFORD, R. T. (2020). The IUCN Global Ecosystem Typology 2.0: Descriptive profiles for biomes and ecosystem functional groups. Gland, Switzerland: International Union for Conservation of Nature.
KIEHL, K., ESSELINK, P. et BAKKER, J. P. 1997. Nutrient limitation and plant species composition in temperate salt marshes. Oecologia, 111, p. 325 à 330.
KING, R. S., DELUCA, W. V., WHIGHAM, D. F. et MARRA, P. P. (2007). Threshold effects of coastal urbanization of Phragmites australis (Common reed) abundance and foliar nitrogen in Chesapeake Bay. Estuaries and Coasts, 30(3), p. 469 à 481.
KING, R. S., HINES, A. H., CRAIGE, F. D. et GRAP, S. (2005). Regional, watershed and local correlates of blue crab and bivalve abundances in subestuaries of Chesapeake Bay, USA. Journal of Experimental Marine Biology and Ecology, 319, p. 101 à 116.
KIRWAN, M. L., GUNTENSPERGEN, G. R. et MORRIS, J. T. (2009). Latitudinal trends in Spartina alterniflora productivity and the response of coastal marshes to global change. Global Change Biology, 15, p. 1982 à 1989. https://doi.org/10.1111/j.1365-2486.2008.01834.x
KIRWAN, M. L., GUNTENSPERGEN, G. R., D'ALPAOS, A., MORRIS, J. T., MUDD, S. M. et TEMMERMAN, S. (2010). Limits on the adaptability of coastal marshes to rising sea level. Geophysical Research Letters, 37, L23401.
KLEIN, J. C., UNDERWOOD, A. J. et CHAPMAN, M. G. (2011). Urban structures provide new insights into interactions among grazers and habitat. Ecological Applications, 21(2), p. 427 à 438.
KONISKY, R. A. et BURDICK, D. M. (2005). Effects of stressors on invasive and halophytic plants of New England salt marshes: A framework for predicting response to tidal restoration. Wetlands, 24(2), p. 434 à 447.
LANGFORD, S. (2015, 7 août). Recipe: Sea asparagus is the most delicious seafood you've never had. Repéré le 2 novembre 2021 à The Globe and Mail: https://www.theglobeandmail.com/life/food-and-wine/recipes/recipe-sea-asparagus-is-the-most-delicious-seafood-youve-never-had/article25876280/
LANGLEY, J. A., MOZDZER, T. J., SHEPARD, K. A., HAGERTY, S. B. et MEGONIGAL, J. P. (2013). Tidal marsh plant responses to elevation CO2, nitrogen fertilization, and sea level rise. Global Change Biology, 19, p. 1495 à 1503.
LEMMEN, D. S., WARREN, F. J., JAMES, T. S. et MERCER CLARKE, C. S. L. (2016). Canada's marine coasts in a changing climate. Ottawa. ON: Government of Canada.
LEO, K. L., GILLIES, C. L., FITZSIMONS, J. A., HALE, L. Z. et BECK, M. W. (2019). Coastal habitat squeeze: A review of adaptation solutions for saltmarsh, mangrove and beach habitats. Ocean and Coastal Management, 175, p. 180 à 190.
LEVINE, J. M., BREWER, J. S. et BERTNESS, M. D. (1998). Nutrients, competition and plant zonation in a New England salt marsh. Journal of Ecology, 86, p. 285 à 292.
LITVIN, S. Y., WEINSTEIN, M. P., SHEAVES, M. et NAGELKERKEN, I. (2018). What makes nearshore habitats nurseries for nekton? An emerging view of the nursery role hypothesis. Estuaries and Coasts, 41, p. 1539 à 1550.
LOPES, C. L., MENDES, R., CAÇADOR, I. et DIAS, J. M. (2020). Assessing salt marsh extent and condition changes with 35 years of Landsat imagery: Tagus Estuary case study. Remote Sensing of Environment, 247, p. 111939.
LUMBIERRES, M., MENDEZ, P. F., BUSTAMANTE, J., SORIGUER, R. et SANTAMARIA, L. (2017). Modeling biomass production in seasonal wetlands using MODIS NDVI land surface phenology. 9(4), p. 392. https://doi.org/10.3390/rs9040392
MACKENZIE, W. H. et MORAN, J. R. (2004). Wetlands of British Columbia: A guide to identification (Land Management Handbook no 52). Victoria, C.-B. : Research Branch, B.C. Ministry of Forests. Repéré le 18 novembre 2021 à https://www.for.gov.bc.ca/hfd/pubs/Docs/Lmh/Lmh52.pdf
MARTINI, P. I., JEFFERIES, R. L., MORRISON, R. I., ABRAHAM, K. F. et SERGIENKO, L. A. (2019). Northern polar coastal wetlands: Development, structure, and land use. Dans G. M. Perillo, E. Wolanski, D. R. Cahoon et C. S. Hopkinson (dir.), Coastal wetlands: An integrated ecosystem approach (2e éd., p. 153 à 186). Elsevier B.V.
MCCLELLAND, J. W. et VALIELA, I. (1998a). Changes in food web structure under the influence of increased anthropogenic nitrogen inputs to estuaries. Marine Ecology Progress Series, 168, p. 259 à 271.
MCCLELLAND, J. W. et VALIELA, I. (1998b). Linking nitrogen in estuarine producers to land-derived sources. Limnology and Oceanography, 43(4), p. 577 à 585.
MCCORMICK, H., SALGUERO-GÓMEZ, R., MILL, M. et DAVIS, K. (2021). Using a residency index to estimate the economic value of coastal habitat provisioning services for commercially important fish species. Conservation Science and Practice, 3(5), e363. https://doi.org/10.1111/csp2.363
MCGARIGAL, K. et MARKS, B. J. (1995). FRAGSTATS: Spatial pattern analysis program for quantifying landscape structure. Portland, OR: U.S. Department of Agriculture, Forest Service, Pacific Northwest Research Station. https://doi.org/10.2737/PNW-GTR-351
MCLEOD, E., CHMURA, G. L., BOUILLON, S., SALM, R., BJÖRK, M., DUARTE, C. M., LOVELOCK, C. E., SCHLENSINGER, W. H., et SILLIMAN, B. R. (2011). A blueprint for blue carbon: Toward an improved understanding of the role of vegetated coastal habitats in sequestering CO2. Frontiers in Ecology and the Environment, 9(10), p. 552 à 560. https://doi.org/10.1890/110004
MCOWEN, C. J., WEATHERDON, L. V., VAN BOCHOVE, J.-W., SULLIVAN, E., BLYTH, S., ZOCKLER, C., STANWELL-SMITH, D., KINGSTON, N., MARTIN, C. S., SPALDING, M. et FLETCHER, S. (2017). A global map of saltmarshes. Biodiversity Data Journal, 5, e11764.
MENDELSSOHN, I. A., ANDERSEN, G. L., BALTZ, D. M., CAFFEY, R. H., CARMAN, K. R., FLEEGER, J. W., JOYE, S. B., LIN, Q., MALTBY, E., OVERTON, E. B. et ROZAS, L. P. (2012). Oil impacts on coastal wetlands: Implications for the Mississippi River Delta ecosystem after the Deepwater Horizon oil spill. BioScience, 62(6), p. 562 à 574.
MEYERSON, L. A., SALTONSTALL, K. et CHAMBERS, R. M. (2009). Phragmites australis in eastern North American: A historical and ecological perspective. Dans B. R. Silliman, E. D. Grosholz et M. D. Bertness (dir.), Human impacts on salt marshes: A global perspective (p. 57 à 82). University of California Press.
MILLER, G. J., MORRIS, J. T. et WANG, C. (2019). Estimating aboveground biomass and its spatial distribution in coastal wetlands utilizing Planet multispectral imagery. Remote Sensing, 11(17). https://doi.org/10.3390/rs11172020
MILLIGAN, D. C. (1987). Maritime dykelands: The 350 year struggle. Nova Scotia Department of Government Services: Publishing Division.
MINCHINTON, T. E., SIMPSON, J. C. et BERTNESS, M. D. (2006). Mechanisms of exclusion of native coastal marsh plants by an invasive grass. Journal of Ecology, 94, p. 342 à 354.
MINELLO, T. J., ZIMMERMAN, R. J. et MEDINA, R. (1994). The importance of edge for natant marofauna in a created salt marsh. Wetlands, 14, p. 184 à 198.
MITCHELL, M. G., SCHUSTER, R., JACOB, A. L., HANNA, D. E., DALLAIRE, C. O., RAUDSEPP-HEARNE, C., BENNETT, E. M., LEHNER, B. et CHAN, K. M. (2021). Identifying key ecosystem service providing areas to inform national-scale conservation planning. Environmental Research Letters, 16(1), 014038.
MO, Y., KEARNEY, M. S., RITER, J. C., ZHAO, F. et TILLEY, D. R. (2018). Assessing biomass of diverse coastal marsh ecosystems using statistical and machine learning models. International Journal of Applied Earth Observation and Geoinformation, 68, p. 189 à 201.
MÖLLER, I., KUDELLA, M., RUPPRECHT, F., SPENCER, T., PAUL, M., VAN WESEBEECK, B. K., WOLTERS, G., JENSEN, K., BOUMA, T. J., MIRANDA-LANGE, M. et SCHIMMELS, S. (2014). Wave attenuation over coastal saltmarshes under storm surge conditions. Nature Geoscience, 7, p. 727 à 731.
MORLEY, S. A., TOFT, J. D. et HANSON, K. M. (2012). Ecological effects of shoreline armoring on intertidal habitats of a Puget Sound urban estuary. Estuaries and Coasts, 35, p. 774 à 784.
MUDD, S. M. (2011). The life and death of salt marshes in response to anthropogenic disturbance of sediment supply. Geology, 39(5), p. 511 à 512. https://doi.org/10.1130/focus052011.1
MUDD, S. M., D'ALPAOS, A. et MORRIS, J. T. (2010). How does vegetation affect sedimentation on tidal marshes? Investigating particle capture and hydrodynamic controls on biologically mediated sedimentation. Journal of Geophysical Research, 115, F03029.
NARAYAN, S., BECK, M. W., WILSON, P., THOMAS, C. J., GUERRERO, A., SHEPARD, C. C., RUGUERO, B. G., FRANCO, G., INGRAM, J. C. et TRESPALACIOS, D. (2017). The value of coastal wetlands for flood damage reduction in the Northeastern USA. Scientific Reports, 7, p. 9463. https://doi.org/10.1038/s41598-017-09269-z
NATIONAL OCEANIC AND ATMOSPHERIC ADMINISTRATION: OFFICE FOR COASTAL MANAGEMENT. (s. d.). C-CAP regional land cover and change. Repéré le 8 decembre 2021 à https://coast.noaa.gov/digitalcoast/data/ccapregional.html
NATIONAL RESEARCH COUNCIL. (2007). Mitigating shore erosion along sheltered coasts. Washington, DC: The National Academies Press. https://doi.org/10.17226/11764
NATIONS UNIES ET COLL. (2021). System of Environmental-Economic Accounting – Ecosystem Accouting (SEEA EA). White cover publication, pre-edited text subject to official editing. Repéré le 8 mars 2022 à https://seea.un.org/fr/ecosystem-accounting
NATURE CONSERVANCY CANADA. (s. d.). Salt marsh copper. Repéré le 4 février 2022 à https://www.natureconservancy.ca/en/what-we-do/resource-centre/featured-species/insects-and-spiders/salt-marsh-copper.html
NELSON, J. L. et ZAVALETA, E. S. (2012). Salt marsh as a coastal filter for the oceans: Changes in function with experimental increases in nitrogen loading and sea-level rise. PLoS One, e38558.
NEUBAUER, S. C. (2008). Salt marsh copper Contributions of mineral and organic components to tidal freshwater marsh accretion. Estuarine, Coastal and Shelf Science, 78, p. 78 à 88. https://doi.org/10.1016/j.ecss.2007.11.011
NEWTON, C. et THORNBER, C. (2012). Ecological impacts of macroalgal blooms on salt marsh communities. Estuaries and Coasts, 36, p. 365 à 376.
NGULUBE, M. (2021). The wave dissipation potential of Spartina alterniflora in the Bay of Fundy [thèse de spécialisation, Saint Mary's University]. Saint Mary's University Institutional Repository.
NIKALJE, G. C. et SUPRASANNA, P. (2018). Coping with metal toxicity – cues from halophytes. Frontiers in Plant Science, 9(777).
NOVA SCOTIA MUSEUM. (2020). Salt marshes. Repéré le 3 février 2022 au Village Historique Acadien: https://levillage.novascotia.ca/what-see-do/salt-marshes
ODUM, W. E. (1988). Comparative ecology of tidal freshwater and salt marshes. Annual Review of Ecology and Systematics, 19, p. 147 à 176.
PAGE, H. M., PETTY, R. L. et MEADE, D. E. (1995). Influence of watershed runoff on nutrient dynamics in a Southern California salt marsh. Estuarine, Coastal and Shelf Science, 41, p. 163 à 180.
PARTYKA, M. L. et PETERSON, M. S. (2008). Habitat quality and salt-marsh species assemblages along an anthropogenic estuarine landscape. Journal of Coastal Research, 24(6), p. 1570 à 1581.
PAYNE, A. R., BURDICK, D. M. et MOORE, G. E. (2019). Potential effects of sea-level rise on salt marsh elevation dynamics in a New Hampshire estuary. Estuaries and Coasts, 42, p. 1405 à 1418. https://doi.org/10.1007/s12237-019-00589-z
PEACH, D. A. et GRIES, G. (2016). Nectar thieves or invited pollinators? A case study of tansy flowers and common house mosquitoes. Arthropod-Plant Interactions, 10, p. 497 à 506.
PENNINGS, S. C. et BERTNESS, M. D. (2001). Salt Marsh Communities. Dans M. D. Bertness, S. D. Gaines et M. E. Hay (dir.), Marine community ecology (p. 289 à 316). Sunderland, Massachusetts: Sinauer Associates.
PENNINGS, S. C., GRANT, M.-B. et BERTNESS, M. D. (2005). Plant zonation in low-latitude salt marshes: Disentangling the roles of flooding, salinity and competition. Journal of Ecology, 93, p. 159 à 167.
PETERSON, M. S. et LOWE, M. R. (2009). Implications of cumulative impacts to estuarine and marine habitat quality for fish and invertebrate resources. Reviews in Fisheries Science, 17(4), p. 505 à 523. https://doi.org/10.1080/10641260903171803
PETERSON, M. S., COMYNS, B. H., HENDON, J. R., BOND, P. J. et DUFF, G. A. (2000). Habitat use by early life-history stages of fishes and crustaceans along a changing estuarine landscape: Differences between natural and altered shoreline sites. Wetlands Ecology and Management, 8, p. 209 à 219.
POJAR, J. (1973). Pollination of typically anemophilous salt marsh plants by bumble bees, Bombus terricola occidentalis Grne. The American Midland Naturalist, 89(2), p. 448 à 451.
PORTER, C., LUNDHOLM, J., BOWRON, T., LEMIEUX, B., VAN PROOSDIJ, D., NEATT, N. et GRAHAM, J. (2015). Classification and environmental correlates of tidal wetland vegetation in Nova Scotia, Canada. Botany, 93(12), p. 825 à 841.
PRATOLONGO, P., LEONARDI, N., KIRBY, J. R. et PLATER, A. (2019). Temperate coastal wetlands: Morphology, sediment processes, and plant communities. Dans G. M. Perillo, E. Wolanski, D. R. Cahoon et C. S. Hopkinson (dir.), Coastal wetlands: An integrated ecosystem approach (2e éd., p. 105 à 152). Elsevier B.V.
RABINOWITZ, T. (2020). Methods of accelerating re-vegetation at Bay of Fundy salt marsh restoration sites: A practical comparison [mémoire de maîtrise, Saint Mary's University]. Saint Mary's University Institutional Repository.
RABINOWITZ, T. R. M., GREENE, L., GLOGOWSKI, A. D., BOWRON, T., VAN PROOSDIJ, D. et LUNDHOLM, J. T. (2022). Hitchhiking halophytes in wrack and sediment-laden ice blocks contribute to tidal marsh development in the Upper Bay of Fundy. Wetlands Ecology and Management, p. 1 à 14. https://doi.org/10.1007/s11273-022-09867-3
RAVIT, B., EHRENFELD, J. G., HÄGGBLOM, M. M. et BARTELS, M. (2007). The effects of drainage and nitrogen enrichment on Phragmites australis, Spartina alterniflora, and their root-associated microbial communities. Wetlands, 27(4), p. 915 à 927.
REDDY, K. R., D'ANGELO, E. M. et HARRIS, W. G. (2000). Biogeochemistry of wetlands. In M. Sumner (dir.), Handbook of soil science (p. G-89 à 119). Boca Raton, Florida: CRC Press.
REED, D. J. (1995). The response of coastal marshes to sea-level rise: Survival or submergence? Earth Surface Processes and Landforms, 20, p. 39 à 48.
REZAIE, A. M., LOERZEL, J. et FERREIRA, C. M. (2020). Valuing natural habitats for enhancing coastal resilience: Wetlands reduce property damage from storm surge and sea level rise. PLoS ONE, 15(1), e0226275. https://doi.org/10.1371/journal.pone.0226275
ROBERTS, B. A. et ROBERTSON, A. (1986). Salt marshes of Atlantic Canada: Their ecology and distribution. Canadian Journal of Botany, 64, p. 455 à 467.
ROCHLIN, I., DEMPSEY, M. E., IWANEJKO, T. et NINIVAGGI, D. V. (2011). Aquatic insects of New York salt marsh associated with mosquito larval habitat and their potential utility as bioindicators. Journal of Insect Science, 11(1). https://doi.org/10.1673/031.011.17201
ROULSTON, T. T. (2021). Pollinator communities in saltmarshes and dykes: Comparing habitat value in agroecosystems [thèse de spécialisation, Saint Mary's University]. Saint Mary's University Institutional Repository.
SAARELA, J. M. (2012). Taxonomic synopsis of invasive and native Spartina (Poaceae, Chloridoideae) in the Pacific Northwest (British Columbia, Washington and Oregon), including the first report of Spartina x townsendii for British Columbia, Canada. PhytoKeys, 10, p. 25 à 82. https://doi.org/10.3897/phytokeys.10.2734
SCHILE, L. M., CALLAWAY, J. C., MORRIS, J. T., STRALBERG, D., PARKER, V. T. et KELLY, M. (2014). Modeling tidal marsh distribution with sea-level rise: Evaluating the role of vegetation, sediment, and upland habitat in marsh resiliency. PLoS One, 9(2), e88760.
SCHULZE, D., RUPPRECHT, F., NOLTE, S. et JENSEN, K. (2019). Seasonal and spatial within-marsh differences of biophysical plant properties – Implications for wave attenuation capacity of salt marshes. Aquatic Sciences, 81(4), p. 1 à 11.
SERRANO, O., KELLEWAY, J. J., LOVELOCK, C. et LAVERY, P. S. (2019). Conservation of blue carbon ecosystems for climate change mitigation and adaptation. Dans G. M. Perillo, E. Wolanski, D. R. Cahoon et C. S. Hopkinson (dir.), Coastal wetlands: An integrated ecosystem approach (2e éd., p. 962 à 996). Elsevier B.V.
SHARP, R., DOUGLASS, J., WOLNY, S., ARKEMA, K., BERNHARDT, J., BIERBOWER, W., CHAUMONT, N., DENU, D., FISHER, D., GLOWINSKI, K., GRIFFIN, R., GUANNEL, G., GUERRY, A., JOHNSON, J., HAMEL, P., KENNEDY, C., KIM, C.K., LACAYO, M., LONSDORF, E., . . . WYATT, K. (2020). InVEST 3.10.2.post17+ug.g0e9e2ef user’s guide. The Natural Captial Project, Stanford University, University of Minenesota, The Nature Conservancy and World Wildlife Fund. Repéré le 31 janvier 2022 à http://releases.naturalcapitalproject.org/invest-userguide/latest/coastal_blue_carbon.html
SHEPARD, C. C., CRAIN, C. M. et BECK, M. W. (2011, novembre 23). The protective role of coastal marshes: A systematic review and meta-analysis. PLoS ONE. https://doi.org/10.1371/journal.pone.0027374
SHERREN, K., ELLIS, K., GULMOND, J. A., KURYBYK, B., LEROUX, N., LUNDHOLM, J., MALLORY, M. L., VAN PROOSDIJ, D., WALKER, A. K., BOWRON, T. M., BRAZNER, J., KELLMAN, L., TURNER II, B. L. et WELLS, E. (2021). Understanding multifunctional Bay of Fundy dykelands and tidal wetlands using ecosystem services–a baseline. FACETS, 6, p. 1446 à 1473.
SIEVERS, M., BROWN, C. J., BUELOW, C. A., PEARSON, R. M., TURSCHWELL, M. P., ADAME, M. F., GRIFFITHS, L., HOLGATE, B., RAYNER, T. S., TULLOCH, V. J. D., CHOWDHURY, M. R., ZU ERMGASSEN, P. S. E., LEE, S. Y., LILLEBØ, A. I., MACKEY, B., MAXWELL, P. S., RAJKARAN, A., SOUSA, A. I. et CONNOLLY, R. M. (2021). Global typologies of coastal wetland status to inform conservation and management. Ecological Indicators, 131, p. 108141.
SILLIMAN, B. R. et BERTNESS, M. D. (2002). A trophic cascade regulates salt marsh primary production. PNAS, 99(16), p. 10500 à 10505.
SILLIMAN, B. R. et BERTNESS, M. D. (2004). Shoreline development drives invasion of Phragmites australis and the loss of plant diversity on New England salt marshes. Conservation Biology, 18(5), p. 1424 à 1434.
SILVESTRI, S. et MARANI, M. (2004). Salt-marsh vegetation and morphology: Basic physiology, modelling and remote sensing observations. Dans S. Fagherazzi, L. Blum et M. Marani (dir.), Ecogeomorphology of tidal marshes (p. 5 à 25). American Geophysical Union, Coastal and Estuarine Monograph Series.
SMITH, S. M. et WARREN, R. S. (2012). Vegetation responses to tidal restoration. Dans C. T. Roman et D. M. Burdick (dir.), Tidal marsh restoration: A synthesis of science and management (p. 59 à 80). Island Press.
SOUSA, A. I., LILLEBØ, A. I., CAÇADOR, I. et PARDAL, M. A. (2008). Contribution of Spartina maritima to the reduction of eutrophication in estuarine systems. Environmental Pollution, 156(3), p. 628 à 635. https://doi.org/10.1016/j.envpol.2008.06.022
SOUSA, A. I., LILLEBØ, A. I., RISGAARD-PETERSEN, N., PARDAL, M. A. et CAÇADOR, I. (2012). Denitrification: An ecosystem service provided by salt marshes. Marine Ecology Progress Series, 448, p. 79 à 92. https://doi.org/10.3354/meps09526
STATISTIQUE CANADA. (2021). Comptabiliser les changements écosystémiques au Canada. L’activité humaine et l’environnement. Repéré le 8 mars 2022 à https://www150.statcan.gc.ca/n1/pub/16-201-x/16-201-x2021001-fra.htm
STATISTIQUE CANADA. (2022). Recensement de l’environnement : une feuille de route vers la durabilité environnementale et économique. Repéré le 31 janvier 2022 à https://www.statcan.gc.ca/fr/sujets-debut/environnement/recensement
STEWART, D. (2021). Undetected but widespread: The cryptic invasion of non-native cattail (Typha spp.) in a Pacific Northwest estuary [mémoire de maîtrise, University of British Columbia]. UBC Theses and Dissertations. https://doi.org/10.14288/1.0397016
SUN, C., FAGHERAZZI, S. et LIU, Y. (2018). Classification mapping of salt marsh vegetation by flexible monthly NDVI time-series using Landsat imagery. Estuarine, Coastal and Shelf Science, 213, p. 61 à 80. https://doi.org/10.1016/j.ecss.2018.08.007
SUTHERLAND, W. et WALTON, D. (1990). The changes in morphology and demography of Iris pseudacorua L. at different heights on a saltmarsh. Functional Ecology, 4(5), p. 655 à 659.
SUTTON-GRIER, A. E., WOWK, K. et BAMFORD, H. (2015). Future of our coasts: The potential for natural and hybrid infrastructure to enhance the resilience of our coastal communities, economies and ecosystems. Environmental Science & Policy, 51, p. 137 à 148.
TAGHADOSI, M. M., HASANLOU, M. et EFTEKHARI, K. (2019). Soil salinity mapping using dual-polarized SAR Sentinel-1 imagery. International Journal of Remote Sensing, 40(1), p. 237 à 252. https://doi.org/10.1080/01431161.2018.1512767
THOMSEN, P. F. et WILLERSLEV, E. (2015). Environmental DNA – An emerging tool in conservation for monitoring past and present biodiversity. Biological Conservation, 183, p. 4 à 18. https://doi.org/10.1016/j.biocon.2014.11.019
THORNTON, A., LUISETTI, T., G. G., DONOVAN, D., PHILLIPS, R. et AND HAWKER, J. (2019). Initial natural capital accounts for the UK marine and coastal environment. Final Report. Rapport préparé pour le Department for Environment Food and Rural Affairs.
TINER, R. W. (2009). Field guide to tidal wetland plants of the northeastern United States and neighboring Canada. Amherst, Massachusetts: University of Massachusetts Press.
TOBIAS, C. et NEUBAUER, S. C. (2019). Salt marsh biogeochemistry – An overview. Dans G. M. Perillo, E. Wolanski, D. R. Cahoon et C. S. Hopkinson (dir.), Coastal wetlands: An integrated ecosystem approach (p. 539 à 596). Elsevier B.V.
TRÉGAROT, E., CATRY, T., POTTIER, A., EL-HACEN, E.-H. M., CHEIKH, M. A., CORNET, C. C., MARCHÉCHAL, J.-P. et FAILLER, P. (2021). Coastal protection assessment: A tradeoff between ecological, social, and economic issues. Ecosphere, 12(2).
TURNER, N. J., DEUR, D. et LEPOFSKY, D. (2013). Plant management systems of British Columbia's first peoples. BC Studies: The British Columbian Quarterly, 179, p. 107 à 133.
TURNER, R. E. (2011). Beneath the salt marsh canopy: Loss of soil strength with increasing nutrient loads. Estuaries and Coasts, 34, 1084–1093.
UNITED STATES GEOLOGICAL SURVEY NATIONAL WETLANDS RESEARCH CENTER. (s. d.). Coastwide reference monitoring system. Repéré le 8 decembre 2021 à https://www.lacoast.gov/crms/
UNITED STATES NATIONAL PARKS SERVICE. (s. d.). Northeast temperate inventory & monitoring network: Rocky intertidal community monitoring in Northeast temperate network parks. Repéré le 8 decembre 2021 à https://www.nps.gov/im/netn/rocky-intertidal-community.htm
UNIVERSITY OF NEW HAMPSHIRE, NATIONAL ESTUARINE RESEARCH RESERVE SYSTEM. (s. d.). eDNA in estuaries. Repéré le 31 janvier 2022 à https://www.estuarydna.org/
VALIELA, I., COLE, M. L., MCCLELLAND, J., HAUXWELL, J., CEBRIAN, J. et JOYE, S. B. (2000). Role of salt marshes as part of coastal landscapes. Dans M. Weinstein et D. A. Kreeger (dir.), Concepts and controversies in tidal marsh ecology (1ere éd., p. 23 à 36). Dordrecht: Springer. https://doi.org/10.1007/0-306-47534-0_3
VALIELA, I., MCCLELLAND, HAUXWELL, J., VEHR, P. J., HERSH, D. et FOREMAN, K. (1997). Macroalgal blooms in shallow estuaries: Controls and ecophysiological and ecosystem consequences. Limnology and Oceanography, 45(5, partie 2), p. 1105 à 1118.
VAN BEIJMA, S., COMBER, A. et LAMB, A. (2014). Random forest classification of salt marsh vegetation habitats using quad-polarimetric airborne SAR, elevation and optical RS data. Remote Sensing of Environment, 149, 118 à 129.
VAN EERDT, M. M. (1985). The influence of vegetation on erosion and accretion in salt marshes of the Oosterschelde, The Netherlands. Vegetation, 62, p. 367 à 373.
VINCE, S. W. et SNOW, A. A. (1984). Plant zonation in an Alaskan salt marsh. Journal of Ecology, 72, p. 651 à 667.
VIND, I. (2018). Developing ecosystem services accounts from land accounts. Danmarks Statistik. Kobenhavn: Danmark Statistik.
VIVIAN-SMITH, G. et STILES, E. W. (1994). Dispersal of salt marsh seeds on the feet and feathers of waterfowl. Wetlands, 14(4), p. 316 à 319.
VUIK, V., HEO, H. Y., ZHU, Z., BORSJE, B. W. et JONKMAN, S. N. (2018). Stem breakage of salt marsh vegetation under wave forcing: A field and model study. Estuarine, Coastal and Shelf Science, 200(5), p. 41 à 58. https://doi.org/10.1016/j.ecss.2017.09.028
WANG, H., HSIEH, Y. P., HARWELL, M. A. et HUANG, W. (2007). Modeling soil salinity distribution along topographic gradients in tidal salt marshes in Atlantic and Gulf coastal regions. Ecological Modelling, 201, p. 429 à 439.
WARREN, R. S., FELL, P. E., GRIMSBY, J. L., BUCK, E. L., RILLING, C. et FERTIK, R. A. (2001). Rates, patterns, and impacts of Phragmites australis expansion and effects of experimental Phragmites control on vegetation, macroinvertebrates, and fish within tidelands of the Lower Connecticut River. Estuaries, 24(1), p. 90 à 107.
WASSON, K., JEPPESEN, R., ENDRIS, C., PERRY, D. C., WOOLFOLK, A., BEHESHTI, K., RODRIGUEZ, M., EBY, R., WATSON, E. B., RAHMAN, F., HASKINS, J. et HUGHES, B. B. (2017). Eutrophication decreases salt marsh resilience through proliferation of algal mats. Biological Conservation, 212(A), p. 1 à 11. https://doi.org/10.1016/j.biocon.2017.05.019
WATMOUGH, S., RABINOWITZ, T. et BAKER, S. (2017). The impacts of pollutants from a major northern highway on an adjacent hardwood forest. Science of the Total Environment, 579(1), p. 409 à 419. https://doi.org/10.1016/j.scitotenv.2016.11.081
WEINSTEIN, M. P. et BALLETTO, J. H. (1999). Does the common reed, Phragmites australis, affect essential fish habitat? Estuaries, 22(3B), p. 793 à 802.
WEIS, J. S. et WEIS, P. (2004). Metal uptake, transport and release by wetland plants: Implications for phytoremediation and restoration. Environment International, 30, p. 685 à 700.
WHITFIELD, A. K. (2017). The role of seagrass meadows, mangrove forests, salt marshes and reed beds as nursery areas and food sources for fishes in estuaries. Reviews in Fish Biology and Fisheries, 27(1), p. 75 à 110.
WILLEMSEN, W. J. M., BORSJE, B. W., VUIK, V., BOUMA, T. J. et HULSCHER, S. J. (2020). Field-based decadal wave attenuating capacity of combinded tidal flats and salt marshes. Coastal Engineering, 156. https://doi.org/10.1016/j.coastaleng.2019.103628
WU, W. (2019). Accounting for spatial patterns in deriving sea-level rise thresholds for salt marsh stability: More than just total areas? Ecological Indicators, 103, p. 260 à 271.
XUE, J. et SU, B. (2017). Significant remote sensing vegetation indices: A review of developments and applications. Journal of Sensors, 2017, 1353691. https://doi.org/10.1155/2017/1353691
YERKES, T. (s. d.). The salt marsh sovereign. Repéré le 4 fevrier 2022 à Ducks Unlimited: https://www.ducks.org/conservation/waterfowl-research-science/the-salt-marsh-sovereig
ZHAO, L.-X., GE, Z.-M., VAN DE KOPPEL, J. et LIU, Q.-X. (2019). The shaping roles of self-organization: Linking vegetation patterning, plant traits and ecosystem functioning. Proceedings of the Royal Society B, 286, 20182859. https://doi.org/10.1098/rspb.2018.2859
ZIEGLER, S. L., BAKER, R., CROSBY, S. C., COLOMBANO, D. D., BARBEAU, M. A., CEBRIAN, J., CONNOLLY, R. M., DEEGAN, L. A., GILBY, B. L., MALLICH, D., MARTIN, C. W., NELSON, J. A., REINHARDT, J. F., SIMENSTAD, C. A., WALTHAM, N. J., WORTHINGTON, T. A. et ROZAS, L. P. (2021). Geographic variation in salt marsh structure and function for nekton: A guide to finding commonality across multiple scales. Estuaries and Coasts, 44, p. 1497 à 1507. https://doi.org/10.1007/s12237-020-00894-y
Annexe A — Méthodes liées à l’étendue
L’étendue des marais salés a été calculée à l’aide des meilleurs ensembles de données disponibles délimitant les marais salés. Les analyses ont été effectuées avec ArcMap 10.8.1. Les ensembles de données sur lesquels reposent les polygones, les traits et les points ont été analysés séparément. Les données sur lesquelles reposent les polygones désignant des marais salés ont été extraites des ensembles de données respectifs à l’aide de la classification unique de l’écosystème des marais salés, ou des types de végétation des marais salés dans chaque ensemble de données, comme ils apparaissent dans les métadonnées respectives. Au besoin, les polygones représentant des marais salés du Canada ont été extraits de données internationales. Les polygones se chevauchant ont été dissous pour créer des polygones reflétant les limites maximales de l’étendue des marais salés, sauf au Nouveau-Brunswick, province pour laquelle on a utilisé les données provinciales de 2021 au lieu des données internationales. Les ensembles de données sur lesquels reposent les traits ont été fusionnés et la classification des rives du marais a été extraite. Les lignes représentant les marais situés le long des Grands Lacs, au-delà de l’extrémité sud de la biorégion marine du golfe du Saint-Laurent, et des affluents du golfe du Saint-Laurent ont été retirées, ceux-ci étant considérés comme des marais d’eau douce. Les points représentant les marais salés canadiens ont été extraits de données internationales. Les points situés à plusieurs kilomètres à l’intérieur des terres ou dans l’océan ont été examinés. Ils ont été retirés lorsque les métadonnées ne fournissaient pas une explication adéquate de leur emplacement, ou ont été déplacés manuellement plus près des côtes si d’autres sources de données confirmaient la présence d’un marais salé dans la région. Les lignes qui croisaient à moins de 1 km les polygones et les points ont été retirées pour créer, d’un type de données à l’autre, des enregistrements mutuellement exclusifs de l’étendue des marais salés.
Annexe B — Glossaire
Abiotique : non vivant
Accrétion : processus par lequel les sols des marais salés sont façonnés — l’accumulation graduelle et la cohésivité des sédiments et des matières organiques sur la surface des marais
Aire protégée ou conservée : zone conservée qui satisfait aux normes de l’objectif 11 d’Aichi. Une aire protégée est consacrée à la conservation, tandis qu’une aire conservée peut viser d’autres objectifs, dans la mesure où dans les faits, elle permet de conserver la biodiversité.
Approche participative : obtention de données ou de renseignements par le recours à un grand nombre de personnes, habituellement au moyen d’Internet
Atténuation : réduction de la force, de l’incidence ou de la valeur de quelque chose
Bénéficiaire : utilisateur ou destinataire tirant des avantages des services écosystémiques
Biomasse : masse de matière organique dans les organismes, ou dans un type d’organisme en particulier
Communauté végétale : regroupement d’espèces végétales différentes vivant ensemble dans un endroit donné
Comptes écosystémiques : application d’un cadre de comptabilité spatialement explicite à des données environnementales pour suivre les variations de l’étendue et de la condition des écosystèmes, ainsi que les changements dans les services écosystémiques
Concurrence : interaction entre les organismes ou les espèces qui tentent d’utiliser les mêmes ressources
Digue : ouvrage de terre en forme de crête érigé pour prévenir l’inondation des terres derrière lui, doté de barrières à sens unique, appelées aboiteaux, qui permettent le drainage de l’eau du côté des hautes terres, mais se ferment du côté opposé pour prévenir les inondations
Élévation : élévation par rapport au niveau moyen de la mer
Espèce d’une grande importance culturelle : espèce d’une grande importance pour une culture donnée ou un peuple donné
Espèce clé : espèce ayant une grande incidence sur son environnement naturel
Espèce endémique : espèce qui ne se trouve que dans un emplacement géographique particulier
Espèce indicatrice : espèce sensible aux modifications environnementales dont la condition peut être utilisée pour fournir une indication de la santé de son environnement naturel
Espèce spécialiste : espèce qui ne peut survivre que dans un habitat présentant un ensemble de conditions précises
Estuaire : zone de transition influencée par les marées et l’océan, et étant située à l’endroit où une rivière d’eau douce débouche sur la mer
Évapotranspiration : processus d’évaporation à la surface terrestre et de transpiration des organismes par lequel l’eau au sol est transférée vers l’atmosphère
GBIF : Système mondial d’informations sur la biodiversité
Herbivorisme : consommation de végétaux par les animaux
Hydrologie des marées : caractéristiques ou étude des eaux de marée sur la Terre, y compris leurs mouvements. Terme utilisé dans ce document pour décrire les caractéristiques des inondations par la marée, y compris leur durée, leur fréquence et leur profondeur.
Hydropériode : période pendant laquelle une superficie de terre est humide
Indice de végétation : calcul reposant sur de multiples bandes spectrales issues de l’imagerie indiquant les propriétés structurelles des végétaux
IVDN : Indice de végétation par différence normalisée
Lisière marine : bord d’un marais, à l’endroit où il rencontre l’océan
Lisière terrestre : bord d’un marais, à l’endroit où il rencontre les terres
Marais : terme utilisé de façon interchangeable avec le terme « marais salé »
Marais littoral : terme utilisé de façon interchangeable avec le terme « marais salé »
Marais salé : tout marais périodiquement inondé d’eau de mer saumâtre ou saline
Marelle : dépression ou flaque peu profonde retenant l’eau et située à la surface d’un marais salé
Mesure : terme utilisé dans le présent document pour désigner une méthode de mesure générale d’une variable
Mesure ou variable de substitution : représentation indirecte
Migration : terme utilisé pour désigner le déplacement horizontal d’un marais salé, habituellement vers les terres
Modèle altimétrique numérique (MAN) : modèle de la surface terrestre
Production primaire : production de substances organiques par le processus de photosynthèse
Recrutement : individus d’une espèce de poisson ayant atteint la taille ou l’âge à partir duquel il est permis de les pêcher
Rhizome : tige souterraine
Richesse des espèces : nombre d’espèces distinctes dans une communauté
SCEE-CE : Système de comptabilité économique et environnementale — Comptes des écosystèmes
Science citoyenne : participation du public à la recherche scientifique
Sédimentation : processus par lequel les sédiments forment un dépôt
Séquestration du carbone : processus par lequel le carbone de l’atmosphère est capté et stocké dans les écosystèmes
Services : voir « Services écosystémiques »
Services écosystémiques : contributions des écosystèmes aux avantages que tirent les humains des milieux naturels
Services finaux : services écosystémiques dont les humains profitent directement
SHC : Service hydrographique du Canada
Terrestre : renvoie à la surface solide de la Terre ou aux organismes qui y vivent
Topographie : caractéristiques de la surface de la Terre
UICN : Union internationale pour la conservation de la nature
Varech : tapis de débris de végétaux, habituellement morts, qui flotte sous l’action des marées et qui peut se déposer sur les marais salés
Variable : composante liée à la condition de l’écosystème ou aux services écosystémiques qui sera mesurée d’une façon ou d’une autre dans les comptes écosystémiques
Zone intertidale : zone côtière inondée entre les marées hautes et basses
Zones bâties : zones majoritairement développées, comme les surfaces pavées, les bâtiments, les zones urbaines et les sites industriels, à une résolution de 30 m ou plus
- Date de modification :